Снижение мышечной массы, силы и работоспособности в космосе - Reduced muscle mass, strength and performance in space
Эта статья поднимает множество проблем. Пожалуйста помоги Улучши это или обсудите эти вопросы на страница обсуждения. (Узнайте, как и когда удалить эти сообщения-шаблоны) (Узнайте, как и когда удалить этот шаблон сообщения)
|
Растущая база данных исследований свидетельствует о том, что скелетные мышцы, особенно постуральные мышцы нижней конечности, во время космического полета подвергаются атрофии и структурным и метаболическим изменениям. Однако взаимосвязь между упражнениями в полете, мышечными изменениями и работоспособностью изучена недостаточно. Следует приложить усилия, чтобы попытаться понять текущее состояние возможностей выполнения учений в полете и после полета и какие цели / целевые области для защиты соответствуют текущей программе учений в полете.
Вступление
С самого начала человеческих космическая программа Была выражена серьезная и обоснованная озабоченность по поводу воздействия на людей микрогравитации космоса из-за потенциальных системных воздействий на земные формы жизни, которые так хорошо адаптированы к земной гравитации. Люди в условиях микрогравитации космоса, в наших нынешних космических аппаратах, подвергаются различным периодам разгрузки скелетных мышц (разгрузке) в зависимости от миссии. Разгрузка скелетной мускулатуры как на Земле, так и во время космического полета приводит к ремоделированию мышцы (атрофический ответ) в качестве адаптации к уменьшенным нагрузкам на нее. В результате происходит снижение силы скелетных мышц, сопротивления усталости, двигательной активности и целостности соединительной ткани. Кроме того, наблюдаются сердечно-легочные и сосудистые изменения, в том числе значительное уменьшение массы эритроцитов, которые влияют на функцию скелетных мышц. Этот нормальный адаптивный ответ на условия микрогравитации по большей части не имеет большого значения для космического корабля. как таковой, но может стать препятствием, приводящим к повышенному риску неспособности или снижению эффективности выполнения членами экипажа физически сложных задач во время выхода в открытый космос или резких переходов в среду с повышенной гравитацией (возвращение на Землю, приземление на поверхность другого планетарного тела ).
В космической программе США единственной мерой противодействия функциональному дефициту скелетных мышц в полете, которая использовалась до сих пор, являются физические упражнения. Аппаратура и протоколы учений в полете менялись от миссии к миссии, в некоторой степени в зависимости от продолжительности миссии и объема космического корабля, доступного для выполнения контрмер. Коллективные знания, полученные в ходе этой миссии, помогли в эволюции оборудования и протоколов упражнений в попытках усовершенствовать подход к предотвращению атрофии мышц, вызванной космическими полетами, и сопутствующего дефицита функции скелетных мышц.
Долгосрочные миссии и исследовательские миссии с несколькими переходами между гравитационными средами представляют наибольшие проблемы для снижения риска и разработки контрмер с доказанной эффективностью.
Российские ученые использовали различные тренажеры и протоколы упражнений в полете во время длительных космических полетов (до одного года и более) на борту космической станции "Мир". На Международной космической станции (МКС) использовалось сочетание силовых и аэробных упражнений. Результаты были приемлемыми в соответствии с текущими ожиданиями в отношении работы членов экипажа по возвращении на Землю. Однако для миссий на Луну, создания лунной базы и межпланетных путешествий на Марс функциональные требования к действиям человека на каждом конкретном этапе этих миссий не были достаточно определены, чтобы определить, соответствуют ли разработанные в настоящее время меры противодействия физическим характеристикам. требования.
Доступ к человеческим членам экипажа во время краткосрочных и долгосрочных миссий для изучения адаптации скелетных мышц к микрогравитации и эффективности контрмер был и остается ограниченным. Следовательно, более полное понимание физиологических моделей для проведения как фундаментальных, так и прикладных исследований скелетных мышц. Были кратко рассмотрены различные модели, по которым было собрано достаточно данных.[1] К таким моделям относятся горизонтальные или головные вниз. постельный режим, сухое погружение постельный режим, иммобилизация конечностей и одностороннее подвешивание нижних конечностей. Хотя ни один из этих наземных аналогов не обеспечивает идеальной имитации воздействия микрогравитации на человека во время космического полета, каждый из них полезен для изучения отдельных аспектов разгрузки мышц, а также для исследования сенсомоторных изменений.
Из-за ограниченного количества космических полетов и количества членов экипажа, в которых могут быть испытаны новые меры противодействия, в будущем при разработке, оценке и проверке новых мер противодействия разгрузке скелетных мышц, вероятно, будут использоваться варианты этих же базовых наземных моделей. Перспективные контрмеры могут включать фармакологические и / или диетические вмешательства, инновационные аппаратные упражнения обеспечивают улучшенные условия погрузки, тренажеры опорно-двигательный аппарат, пассивные устройства, физические упражнения и искусственную гравитацию либо в качестве неотъемлемого компонента космического аппарата или в качестве дискретного устройства, содержащегося в нем. Что касается последнего, то недавно были описаны гемодинамические и метаболические ответы на повышенную нагрузку, обеспечиваемую центрифугой с приводом от человека.[2] Совсем недавно одна и та же группа исследователей разработала подход к обеспечению как аэробных, так и силовых упражнений путем включения платформы в виде клетки в конструкцию.
Исследования на животных, проводимые как во время космического полета, так и при наземном моделировании разгрузки скелетных мышц, связанного с космическим полетом, внесли вклад в базу научных знаний таким образом, который невозможно полностью реализовать только с помощью пилотируемых космических полетов и наземных аналоговых исследований. Это связано с тем, что многие переменные, присутствующие в исследованиях на людях, можно более строго контролировать в исследованиях на животных, а гораздо большее количество животных, типичных для таких экспериментов, способствует большей статистической мощности для выявления различий. Основным преимуществом использования моделей грызунов является то, что адаптивные изменения как в космическом полете, так и в подвешивании задних конечностей происходят в гораздо более короткие сроки, чем у людей (часы или дни, а не дни или недели). Это позволяет прогнозировать долгосрочные изменения в скелетных мышцах человека на основе более коротких абсолютных временных рамок исследований на грызунах. Кроме того, можно провести строго контролируемый, простой эксперимент на грызунах, не требуя применения каких-либо контрмер, которые вводят вмешивающуюся переменную. В исследованиях на людях невозможно по этическим соображениям отказаться от контрмер, которые, как известно, обладают некоторой степенью эффективности, чтобы обеспечить популяцию субъектов истинного контроля, в которых видны только эффекты космического полета, для сравнения с субъектами, использующими методы противодействия. Исследования на животных не страдают такими ограничениями. Необходима дальнейшая работа для лучшего понимания проблемы, что позволит использовать новые подходы к противодействию потере функции скелетных мышц, связанной с космическими полетами у людей. Представлены соответствующие исследования космических полетов на животных, а также исследования с использованием парадигм разгрузки мышц, которые вносят вклад в нашу текущую базу знаний.
Исторический обзор
Программы пилотируемых космических полетов США
Меркурий и Близнецы
Перед запуском первого американского астронавта суборбитальные полеты нечеловеческих приматов (шимпанзе) продемонстрировали, что запуск и вход в космос, а также кратковременное воздействие микрогравитации - все это жизнеспособные события.[3]
Первоначальной биомедицинской проблемой, с которой столкнулся проект «Меркурий» (который проводился с 1959 по 1963 год), было установление критериев отбора для первой группы космонавтов. Медицинские требования для астронавтов Меркурия были сформулированы Комитетом НАСА по наукам о жизни, консультативной группой выдающихся врачей и ученых-биологов. Окончательные критерии отбора включали результаты медицинского обследования, а также технические знания и опыт кандидатов. Для проведения стрессового и психологического тестирования кандидатов в космонавты были вызваны авиационный медицинский персонал и объекты Министерства обороны (DoD). Процедуры отбора и тестирования, определенные для отбора астронавтов Меркурия, послужили основой для последующего отбора астронавтов Близнецов и Аполлона, когда эти программы были запущены.
В то время как полеты на Меркурии были в основном демонстрационными, а самая продолжительная миссия Меркурия составила всего около 34 часов, проект Меркурий ясно продемонстрировал, что люди могут переносить космические полеты без серьезных острых физиологических эффектов, и была получена некоторая полезная биомедицинская информация, которая включала следующее:[4]
- Летно-технические характеристики пилота не зависят от космического полета
- Все измеренные физиологические функции оставались в допустимых пределах нормы.
- Признаков аномальных сенсорных или психологических реакций не наблюдалось.
- Полученная доза облучения считалась незначительной с медицинской точки зрения.
- Сразу после приземления было отмечено ортостатическое повышение частоты сердечных сокращений и падение системного артериального давления, которое сохранялось в течение 7-19 часов после приземления.
Из-за короткий промежуток времени Миссии проекта Mercury, было небольшое беспокойство о потере мышечной функции; следовательно, не было разработано никаких тренажеров или протоколов для использования во время полета. Однако критерии отбора обеспечивали отличную физическую форму космонавтов перед полетом.
Биомедицинская информация, полученная во время полетов Меркурия, дала положительную основу для перехода к следующему этапу, программе Gemini, которая осуществлялась в течение 20 месяцев с марта 1965 года по ноябрь 1966 года. Основной заявленной целью программы Gemini было достижение высокого уровня оперативной уверенности при полетах человека в космос. Чтобы подготовиться к миссии по высадке на Луну, необходимо было реализовать три основные цели. Это были:
- осуществить сближение и стыковку двух космических аппаратов
- для выполнения внекорабельной деятельности и проверки систем жизнеобеспечения человека и возможностей космонавтов в таких условиях
- (имеет отношение к этой теме), чтобы лучше понять, как люди переносят длительные периоды полета в невесомости.
Таким образом, проект «Близнецы» предоставил гораздо лучшую возможность изучить влияние микрогравитации космического полета на людей. Во время 14-дневного полета Gemini 7 были предприняты важные наблюдения для более тщательного изучения физиологических и психологических реакций космонавтов в результате воздействия космического полета и связанной с ним микрогравитации.
В результате программы «Близнецы» астронавты США провели около 2000 человеко-часов в невесомости. Дополнительные наблюдения включали наличие постполетной ортостатической непереносимости, которая все еще сохранялась в течение 50 часов после приземления у членов экипажа, снижение массы эритроцитов на 5-20% от предполетных уровней и рентгенологические признаки деминерализации костей в пяточной кости. Не было отмечено значительного ухудшения выполнения задач миссии, и не было получено никаких конкретных измерений силы мышц или выносливости, которые сравнивали бы уровни до, в полете и после полета.
Аполлон
Основной целью программы «Аполлон» была высадка космонавтов на поверхность Луны и их последующее безопасное возвращение на Землю. Биомедицинские результаты Аполлона (1968–1973) были собраны из 11 миссий с экипажем, которые были выполнены в течение пятилетнего периода действия программы Аполлон, из предлунных полетов (миссии с 7 по 10); первая посадка на Луну (миссия 11) и пять последующих лунных исследовательских полетов (миссии с 12 по 17). Аполлон-13 не завершил запланированную посадку на Луну из-за взрыва сосуда высокого давления в служебном модуле. Вместо этого он благополучно вернулся на Землю после выхода на частичную лунную орбиту.
Для успешного завершения программы «Аполлон» было необходимо, чтобы некоторые члены экипажа совершали длительные и напряженные периоды выхода в открытый космос на поверхности Луны. Были опасения по поводу способности членов экипажа совершить экскурсии на поверхность Луны, запланированные для некоторых миссий Аполлона. Хотя ожидалось, что пониженная лунная гравитация сделает некоторые задачи менее напряженными, ограниченная мобильность костюма в сочетании со сложной и амбициозной временной шкалой привела к предсказанию, что метаболическая активность будет превышать итоговые уровни в течение длительных периодов времени. Поскольку природа и масштабы физиологической дисфункции, возникающей в результате воздействия микрогравитации, еще не были установлены (и до сих пор не определены в сжатой форме), соответствующие физиологические испытания были проведены в рамках ограничений программы Apollo, чтобы определить, изменились ли физиологические реакции членов экипажа на упражнения как Последствие космического полета.
Первоначальное планирование программы «Аполлон» включало в себя измерения в полете основных параметров, вызывающих озабоченность, включая физиологические реакции на упражнения. Однако пожар на космическом корабле Apollo 204 (также известный как Apollo 1), ставший фатальным для астронавтов Гриссома, Уайта и Чаффи, привел к тому, что руководство НАСА инициировало изменения в программе, исключающие такие перспективы. Таким образом, у исследователей была только возможность провести предполетные и послеполетные исследования реакции на упражнения и предположить, что эти результаты отражают изменения функции сердечно-легочных и скелетных мышц, вторичные по отношению к воздействию микрогравитации. На раннем этапе было осознано, что в контексте и ограничениях, налагаемых реалиями миссий Аполлона, неспособность контролировать определенные экспериментальные переменные создаст проблемы для многих биомедицинских исследований. Во-первых, повторная адаптация к процедурам земной гравитации внесла дополнительные сложности в хорошо управляемый план эксперимента, поскольку члены экипажа Аполлона проводили разное количество времени в неудобно теплом космическом корабле, покачивающемся в океане, и, кроме того, ограничения орбитальной механики на время входа в атмосферу наложили экипаж. время восстановления, которое предотвратило возможность проведения до- и послеполетных испытаний в рамках аналогичного циркадного графика. Эффект этих неконтролируемых состояний и других физических и психологических стрессов нельзя было отделить от реакций, связанных только с воздействием микрогравитации. Таким образом, данные, касающиеся физиологической реакции астронавтов Аполлона на физическую нагрузку, должны интерпретироваться в этом общем контексте.
Ни для одного из полетов Apollo не планировалось никакой стандартной программы тренировок в полете; однако в некоторых миссиях было предоставлено устройство для упражнений (рис. 6-1). Члены экипажа, находясь в командном модуле (CM), обычно использовали тренажер несколько раз в день в течение 15–20 минут.
Предполетное и послеполетное тестирование состояло из поэтапных нагрузочных тестов, проводимых на велоэргометре.[5] Частота сердечных сокращений использовалась для определения уровня стресса,[6] одинаковые уровни пульса использовались для тестирования до и после полета.

Хотя точная продолжительность каждого уровня стресса была немного скорректирована (1-2 минуты) для более поздних миссий Аполлона для получения дополнительных измерений, протокол градуированного стресса включал уровни упражнений 120, 140 и 160 ударов в минуту, соответствующие легкой, средней нагрузке. , и тяжелая работа соответственно для каждого человека. Для миссий Аполлон 9 и 10 был добавлен уровень стресса 180 ударов в минуту. Полный протокол испытаний проводился трижды в течение 30 дней перед стартом. Послеполетные испытания проводились в день подъема (посадки) и еще раз через 24–36 часов после подъема.
Во время каждого теста рабочая нагрузка, частота сердечных сокращений, артериальное давление и дыхательный газообмен (O2 расход, CO2 производства и минутного объема). Для миссий Аполлон 15–17 измерения сердечного выброса были получены методом однократного дыхания.[7][8] Разницу артериовенозного кислорода рассчитывали на основе данных измерения потребления кислорода и сердечного выброса.
Собранные данные были объемными и суммированы в табличной форме Rummel et al.[5] Дитлейн представил краткий обзор результатов.[9] Вкратце, снижение работоспособности и существенное потребление кислорода было отмечено у 67% (18 из 27) членов экипажа «Аполлона», испытанных на восстановление. Это снижение было временным, и 85% испытуемых (23 из 27) вернулись к предполетным исходным уровням в течение 24–36 часов. Значительное уменьшение сердечного ударного объема было связано со снижением толерантности к физической нагрузке. Было неясно, началось ли снижение упражнения во время полета. Если это так, данные Аполлона не показали точного курса времени в полете из-за отсутствия возможностей измерения в полете. Действия астронавтов на поверхности Луны не давали оснований полагать, что во время полета произошло какое-либо серьезное снижение толерантности к физической нагрузке, за исключением того, что связано с отсутствием регулярных упражнений и атрофией неиспользования мышц.[9]
Исследования, проведенные во время Аполлона, хотя и не были оптимальными, не оставили сомнений в том, что снижение толерантности к физической нагрузке произошло сразу после приземления, хотя считается, что такого снижения не было во время поверхностного выхода в открытый космос. Кажется вероятным, что наблюдаемые сокращения ответственны за несколько факторов. Вероятно, этому способствовало отсутствие достаточных физических упражнений и развитие атрофии неиспользования мышц. Катаболические процессы в тканях могли быть усилены повышенной секрецией кортизола в результате стресса во время полета и реакции отдельных членов экипажа на такой стресс. Также могут быть задействованы дополнительные факторы, связанные с возвратом к земной гравитации. Это, наблюдаемое уменьшение ударного объема (сердечного выброса), безусловно, вносит свой вклад и, в свою очередь, является отражением уменьшенного венозного возврата и сокращенного эффективного объема циркулирующей крови, вызванного факторами космического полета.[9] Атрофия скелетных мышц упоминается в связи с ее возможным вкладом в непереносимость физических упражнений, и в некоторых из более поздних полетов Аполлона были выполнены измерения обхвата нижних конечностей (данные не опубликованы), которые предоставили первое свидетельство потери мышечной массы в ногах.
Скайлаб
Программа Skylab (май 1973 - ноябрь 1974) с самого начала была предназначена для создания лаборатории наук о жизни в космосе. Было проведено значительное количество экспериментов для получения физиологических данных о людях, подвергшихся длительному пребыванию в условиях микрогравитации.
56-дневное наземное моделирование многих экспериментов Skylab, проведенное в закрытой камере с контролируемой окружающей средой, было названо высотным тестом для медицинских экспериментов Skylab (SMEAT) и представляло собой первую миссию. Три последующих орбитальных полета были названы "Скайлэб 2", "3" и "4. Продолжительность этих трех длительных миссий составила 28, 56 и 84 дня соответственно. В совокупности миссии Skylab достигли важной вехи в предоставлении огромного массива биомедицинской информации о полетах человека в космос во время более продолжительных миссий, чем любые предыдущие миссии.
Что касается текущей проблемы потери мышечной массы и функции, в ходе трех орбитальных миссий Skylab были проведены два ключевых исследования. Сначала вычисляли объемы ног и рук, измеряя обхват (окружность) смежных 3-сантиметровых сегментов руки и ноги, рассматривая все сегменты как короткий конический цилиндр, а затем суммируя объемы сегментов для получения объема каждой конечности.
Второе исследование включало первые измерения силы мышц с помощью динамометра.[10][11] В дополнение к измерениям, относящимся непосредственно к силе и массе скелетных мышц, были проведены косвенные измерения, которые продемонстрировали, что у всех членов экипажа Skylab был отрицательный азотный баланс.[12] указывает на истощение скелетных мышц. Это также наблюдалось 10 лет спустя у кратковременных членов экипажа космического челнока.[13]
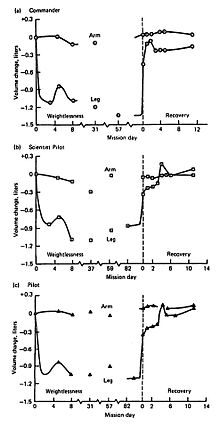
Объемы верхних и нижних конечностей, полученные у трех членов экипажа Skylab 4, показаны на рисунке 6-2. Сдвиги жидкости внесли самые большие изменения в объемы нижних конечностей, но потеря массы тканей ног явно очевидна, особенно в Commander. Как показано на графиках, значительная потеря объема ног происходит в течение первых нескольких дней воздействия микрогравитации, в то время как изменения в верхних конечностях менее заметны. По возвращении на Землю большая часть потери объема ноги корректируется, и часто происходит кратковременная перекомпенсация или перерегулирование. Как только этот жидкостный сдвиг разрешается, выявляется истинная потеря мышечной массы, остающаяся в ногах, которая более медленно возвращается к исходному уровню или уровню перед полетом (см. Рисунок 6-2, нога во время восстановления в правой части графика для всех трех членов экипажа).
В Skylab 4 Commander потеря объема ног составляет почти 300 куб. (Рисунок 6-2, самый верхний график). Поскольку комплект оборудования для упражнений для этой миссии был самым большим (состоящий из велоэргометра, пассивной беговой дорожки и «мини-спортзала», модифицированных коммерческих устройств, обеспечивающих возможность выполнения резистивных упражнений с низкой нагрузкой), потери в мышечной массе и силе были меньше, чем в двух предыдущих миссиях меньшей продолжительности.
Во время программы Skylab упражнения и устройства для упражнений добавлялись постепенно, а тестирование расширялось с каждой миссией. Это создавало разные условия для тренировок для каждого полета, так что на самом деле было три отдельных, но связанных орбитальных эксперимента, каждый с N = 3. Результаты каждой миссии существенно повлияли на следующую.[10]
Предполетная и послеполетная оценка мышечной силы проводилась на правой руке и ноге каждого члена экипажа для всех трех орбитальных миссий Skylab с помощью изокинетического динамометра Cybex.[10] Протокол, выполненный для каждого члена экипажа, включал тщательную разминку и 10 полных сгибаний и разгибаний с максимальным усилием руки в локте, бедра и колена с угловой скоростью 45 ° в секунду. Изокинетическая сила ног из всех трех миссий, а также вес тела и объем ног представлены на рис. 6-3.

На Skylab 2 для упражнений в полете был доступен только велоэргометр, испытания проводились за 18 дней до запуска и через 5 дней после приземления. Хотя было ясно, что это время слишком далеко от времени полета, это было лучшее, чего можно было достичь из-за ограничений расписания. К тому времени, когда тестирование мышц было завершено, вероятно, произошло некоторое восстановление функции; однако заметный спад все же остался. Снижение силы разгибателей ног составило почти 25%; оружие пострадало меньше, но и понесло заметные потери (данные не показаны). Разгибатели рук командира не показали никаких потерь, так как он использовал эти мышцы при ручном управлении велосипедом, будучи единственным членом экипажа Скайлэба, который применил этот режим упражнений для рук. Это проиллюстрировало фундаментальный момент в мышечной подготовке: чтобы поддерживать силу мышцы, она должна быть подвергнута стрессу до или около того уровня, на котором она должна будет функционировать. Мышцы-разгибатели ног, важные для стояния и обеспечения движущих сил во время ходьбы, способны создавать силы в сотни фунтов, в то время как силы разгибателей рук измеряются десятками фунтов. Усилие, развиваемое при вращении педалей на велоэргометре, обычно составляет десятки фунтов и, таким образом, не способно поддерживать силу ног. Велосипедный эргометр оказался отличным тренажером для аэробных упражнений и сердечно-сосудистой системы, но он не был способен развивать ни тип, ни уровень сил, необходимых для поддержания силы при ходьбе ниже 1G.[10]
Сразу после Skylab 2 была начата работа над устройствами, обеспечивающими адекватные упражнения для рук, туловища и ног. Коммерческое устройство, получившее название «Mini Gym», было значительно модифицировано и получило обозначение «MK-I». С этим устройством можно было выполнять только те упражнения, которые в первую очередь полезны для рук и туловища. Хотя силы, передаваемые на ноги, были больше, чем силы, передаваемые велоэргометром, они все же были ограничены до недостаточного уровня, поскольку этот уровень не мог превышать максимальную силу рук, которая представляет собой долю силы ног.[10]
Второе устройство, обозначенное «MK-II», состояло из пары ручек, между которыми можно было прикрепить до пяти пружин растяжения, что позволяло развивать максимальную силу 25 фунтов на фут. Эти два устройства летали на Skylab 3, и было увеличено питание во время полета, а также время упражнений и питание. Экипаж выполнял за день много повторений своих любимых маневров на МК-I и в меньшей степени на МК-II. Кроме того, средний объем работы, выполняемой на велоэргометре, был увеличен более чем вдвое на Skylab 3, при этом все члены экипажа приняли активное участие.
Ученые-биологи Skylb посчитали, что устройство, позволяющее ходить и бегать под действием силы, эквивалентной земной гравитации, обеспечит более интенсивные упражнения.[10] Сразу после завершения Skylab 2 были начаты работы по созданию беговой дорожки для Skylab 4. По мере подготовки к миссии стартовый вес Skylab 4 увеличивался настолько, что окончательный дизайн беговой дорожки был ограничен по весу. Окончательный вес устройства составлял всего 3,5 фунта. Это пассивное устройство (рис. 6-4) состояло из алюминиевой пешеходной поверхности с тефлоновым покрытием, прикрепленной к полу из решетки Skylab. Четыре резиновых эластичных шнура имели эквивалентный вес около 80 килограммов (175 фунтов) и были прикреплены к плечевым и поясным ремням, которые члены экипажа носили во время использования. Путем наклона эластичных шнуров так, чтобы пользователь был слегка вытянут вперед, был создан эквивалент скользкого холма. На некоторые мышцы ног, особенно на икроножные мышцы, были возложены высокие нагрузки, и утомляемость была настолько быстрой, что устройство нельзя было использовать для значительной аэробной работы из-за конструкции ремня безопасности. Совершенно необходимо было носить носки и не носить обувь, чтобы обеспечить соединение с тефлоновой поверхностью с низким коэффициентом трения.

На Skylab 4 команда использовала велоэргометр практически с той же скоростью, что и на Skylab 3, а также тренажеры MK-I и MK-II Mini Gym. Кроме того, они обычно отрабатывали 10 минут в день ходьбы, прыжков и бега на беговой дорожке. Прием пищи снова увеличился.
По возвращении на Землю и даже до тестирования мышц было очевидно, что члены экипажа Skylab 4 были в очень хорошем физическом состоянии. Они могли стоять и ходить в течение длительного времени без видимых затруднений на следующий день после приземления (R + 1), в отличие от членов экипажа из двух предыдущих миссий. Результаты силовых испытаний подтвердили удивительно небольшую потерю силы ног даже после почти 3 месяцев воздействия микрогравитации (рис. 6-3). Фактически, сила разгибателей колена увеличилась по сравнению с предполетным уровнем (рис. 6-13).
Космический шатл
В ходе программы космических шаттлов (1981–2011 гг.) Были завершены различные исследования, связанные с функцией скелетных мышц. Самым полным из них был комплекс исследований, проведенных в рамках Медицинского проекта орбитального аппарата увеличенной продолжительности (EDOMP), который проводился в период 1989–1995 годов с полетами продолжительностью до 16 дней. Исследования, наиболее относящиеся к риску, которому посвящен настоящий отчет, включают следующее:
- DSO 475 - Прямая оценка атрофии мышц и биохимии до и после космического полета
- DSO 606 - Оценка концентрических и эксцентрических сокращений скелетных мышц после космического полета
- DSO 617 - Оценка функциональной производительности мышц

Общей конкретной целью DSO 477 и DSO 617 была оценка функциональных изменений концентрической и эксцентрической силы (максимальный крутящий момент) и выносливости (индекс усталости) туловища, рук и ног членов экипажа до и после полета. Для оценки концентрических и эксцентрических сокращений до и после полета использовался динамометр LIDO®, расположенный в Космическом центре Джонсона и в местах основной и резервной посадки.
Испытуемые в этом исследовании тренировались во время полета в течение различной продолжительности, интенсивности и количества дней на оригинальной беговой дорожке Shuttle (рис. 6-5) (в отличие от беговой дорожки EDO, которая выполняла более поздние миссии Shuttle и служила базой для беговой дорожки ISS. ) в рамках отдельных расследований в полете. Протоколы упражнений включали непрерывные и интервальные тренировки с предписаниями, варьирующимися от 60% до 85% предполетной VO.2-макс по оценке частоты пульса (ЧСС). Некоторые испытуемые испытывали трудности с достижением или поддержанием целевого ЧСС во время полета. Тормоз (рисунок 6-5). Для моделирования веса тела использовалась система ремней безопасности и троса / страховочного троса, обеспечивающая силы, эквивалентные приблизительной массе тела 1G. Subjects on this non-motorized treadmill were required to walk and run at a positive percentage grade to overcome mechanical friction. Study participants were familiarized with the LIDO® test protocol and procedures about 30 days before launch (L-30), after which six test sessions were conducted. Three sessions were completed before launch (L-21, L-14 and L-8 days) and three after landing (R+0, R+2 and R+7 to R+10 days).
The muscle groups tested are shown in table 6-1. Torque and work data were extracted from force-position curves. Peak-torque, total work, and fatigue index measured in the three preflight test sessions were compared; when no differences were found between sessions, values from the three preflight sessions were averaged and this average was used to compare preflight values with those on landing day and during the postflight period.
Skeletal-muscle strength was defined as the peak torque generated throughout a range of motion from three consecutive voluntary contractions for flexion and extension. Eccentric contractions are actions of the muscle in which force is generated while the muscle is lengthening, as opposed to the concentric actions in which the muscle is shortening (contracting) while generating force. Skeletal-muscle endurance was defined as the total work generated during 25 repetitions of concentric knee exercise, as determined from the area under the torque curve for a complete exercise set. Work also was compared between the first 8 and last 8 repetitions. Endurance parameters were measured during concentric knee flexion and extension activity only. On R+0, significant decreases in concentric and eccentric strength were shown in the back and abdomen when compared to the preflight means (table 6-1).
| Muscle Group | Test Mode | |
|---|---|---|
| Концентрический | Эксцентричный | |
| Назад | -23 (±4)* | -14 (±4)* |
| Брюшная полость | -10 (±2)* | -8 (±2)* |
| Квадрицепс | -12 (±3)* | -7 (±3) |
| Подколенные сухожилия | -6 (±3) | -1 (±0) |
| Tibialis Anterior | -8 (±4) | -1 (±2) |
| Gastroc/Soleus | 1 (±3) | 2 (±4) |
| Дельтовидные мышцы | 1 (±5) | -2 (±2) |
| Pecs/Lats | 0 (±5) | -6 (±2)* |
| Бицепс | 6 (±6) | 1 (±2) |
| Трицепс | 0 (±2) | 8 (±6) |
| *Preflight >R+0 (p < ); n=17 | Landing day (R+0) versus average of 3 preflight measures. From reference (14)[14] | |
Concentric back extension and eccentric dorsiflexion remained significantly less than preflight values on R+7. Recovery (an increase in peak torque from R+0 to R+7) was demonstrated for the eccentric abdomen and the concentric and eccentric back extensors.
However, the data depicted in table 6-1 may be somewhat misleading because in some cases there were tremendous differences in strength between crewmembers who exercised during flight versus those who did not. For example, some crewmembers who exercised during flight actually gained in isokinetically measured strength in the ankle extensor/flexor muscles (anterior versus posterior calf muscles, that is м. передняя большеберцовая мышца versus the gastrocnemius/soleus complex) compared to crewmembers who did not exercise and who actually showed a decrease in isokinetically measured strength in these muscles (figure 6-6).

With respect to endurance, a majority of the decrease in the total quadriceps work occurred on R+0. This likely reflects significant loss in the first third of the exercise bout (-11%). The declines in peak torque at the faster endurance test velocities are consistent with changes seen at the slower angular velocity used during the strength tests. Torque for the quadriceps at 75° per second was 15% less than preflight values but for the hamstrings was 12% less than the preflight mean at 60° per second. Endurance data showed little difference between preflight and R+7 tests, suggesting that crewmembers had returned to baseline by 1 week after landing.
Additionally, subjects who did exercise during flight compared to those who did not had significantly greater (п < 0.05) losses within 5 hours of landing in concentric strength of the back, concentric and eccentric strength of the quadriceps (30° per second), and eccentric strength of the hamstrings, relative to the respective preflight values (data not shown here).[14] According to Greenisen et al., non-exercisers also had significantly less concentric strength of the quadriceps at 75° per second and lower total work extension, work first-third flexion, and work last-third extension, immediately after landing, than before flight. The conclusions reached by the investigators were that the data indicate that muscles are less able to maintain endurance and resist fatigue after spaceflight, and that exercise may avert decrements in these aspects of endurance.[14]
Conversely, crewmembers who exercised during flight had greater losses in trunk muscles strength as measured at landing than did the non-exercising group (figure 6-7). However, preflight strength in trunk flexion and extension was substantially greater in the exercising group than in the non-exercising group. Apparently treadmill exercise did not prevent decrements in trunk strength after 9 to 11 days of spaceflight, and the investigators proffered the explanation that preservation of muscle function may be limited only to those muscles that are effectively used as part of the exercise regimen.

The specific aim of DSO 475, "Direct Assessment of Muscle Atrophy Before and After Short Spaceflight" was to define the morphologic and biochemical effects of spaceflight on skeletal fibers.[14] To obtain myofiber biomechanical and morphological data from Space Shuttle crewmembers, biopsies were conducted once before flight (L - > 21 days) and again on landing day (R+0). The subjects were eight crewmembers, three from a 5-day mission and five from an 11-day mission. Biopsies of the mid-portion of the м. широкая широкая мышца бедра were obtained by means of a 6-mm biopsy needle with suction assist. A one-tailed paired т-test was used to identify significant differences (п < 0.05) between the mean values of fiber cross-sectional area (CSA), fiber distribution, and number of capillaries of all crewmembers before flight and the mean values for all crewmembers after flight.
According to this report,[14] CSA of slow-twitch (Type I) fibers in postflight biopsies was 15% less than in preflight biopsies; the CSA of fast-twitch (Type II) fibers was 22% less after flight than before (figure 6-8). Mean values did not reflect the considerable variation seen in the biopsies from the eight astronauts who participated. At least some of this variation likely resulted from differences in the types and quantities of preflight and in-flight countermeasures (exercise or LBNP) used by the different crewmembers. The relative proportions of Type I and Type II fibers were different before and after the 11 day mission: the fiber distribution also seemed to follow the same trend after the 5 day mission (more Type II and fewer Type I fibers after than before), but the sample size was too small to reach statistical significance. The number of capillaries per fiber was significantly reduced after 11 days of spaceflight.

However, since the mean fiber size was also reduced, the number of capillaries per unit of CSA of skeletal muscle tissue remained the same. [14][15] Atrophy of both major myofiber types, with atrophy of Type II > Type I, is somewhat different from the more selective Type I myofiber atrophy observed in unloaded Sprague-Dawley and Wistar rat muscle [16][17][18] representing an uncommon case in which difference exist between responses of human and murine skeletal muscle.
The purpose of DSO 606, "Quantifying Skeletal Muscle SIze by Magnetic Resonance Imaging (MRI)," was to non-invasively quantify changes in size, water, and lipid composition in antigravity (leg) muscles after spaceflight. This experiment was the first attempt to measure limb volumes before and after flight since the less sophisticated methods of measuring limb girths during Apollo and SKylab programs were used. The subjects included a total of eight Space Shuttle crewmembers, five from a 7-day flight and three from a 9-day flight. All subjects completed one preflight and two postflight tests on either L-30 or L-16 and on R+2 and R+7. Testing involved obtaining an MRI scan of the leg (soleus and gastrocnemius) at The University of Texas - Houston Health Science Center, Hermann Hospital. Multi-slice axial images of the leg were obtained to identify and locate various muscle groups. Changes in water and lipid content were measured, in addition to CSA, to distinguish changes in fluid versus tissue volumes. Multiple slices were measured by computerized planimetry.
CSA and volume of the total leg compartment, soleus, and gastrocnemius were evaluated to assess the degree of skeletal muscle atrophy. The volumes of all 3 compartments were significantly smaller (п < 0.05) after both the 7 and 9 day Shuttle flights than they were before flight. Volume decreased by 5.8% in the soleus, 4.0% in the gastrocnemius, and 4.3% in the total compartment. These losses were stated to represent the true level of skeletal muscle tissue atrophy and not changes associated with fluid shifts.[14] No recovery was apparent by 7 days after landing (data not shown). This finding indicates that the losses were not due to fluid shifts, but the delay in recovery after these rather short flights is contrary to what was observed and documented during the Skylab program of flights much longer in duration, albeit by less sophisticated methods during Skylab.
The Space Shuttle Program and, in particular, EDOMP has provided a great deal of knowledge about the effects of spaceflight on human physiology and specifically on alterations in skeletal muscle mass, strength, and function. Once again, losses of skeletal muscle mass, strength, and endurance were documented, in some cases in spite of exercise countermeasures. But some findings were encouraging, particularly indications that in-flight exercise does have a positive effect in countering losses in muscle strength at least in the legs (see table 6-1 and figure 6-6), as predicted from the results of the 84-day Skylab 4 mission when multiple modesof exercise were used including a unique "treadmill" device (see figure 6-4). This unusual treadmill provided loads of sufficient magnitude to the legs in a fashion approaching resistance exercise. However, the data provided by MRI volume studies indicate that not all crewmembers, despite utilization of various exercise countermeasures, escape the loss in muscle mass that has been documented during most of the history of U.S. human spaceflight since Project Mercury. This, additional research is needed to continue the development of countermeasures and equipment that will eventually provide a successful solution for all human space travelers.
Shuttle-Mir and NASA-Mir
During the seven NASA-Mir flights, seven U.S. astronauts trained and flew jointly with 12 Russian cosmonauts over a total period of 977 days (the average stay was 140 days) of spaceflight, which occurred during the period from March 1995 to June 1998. The major contribution of the joint U.S./Russian effort on the Mir space station relevant to the current risk topic was the first use of MRI to investigate volume changes in the skeletal muscles of astronauts and cosmonauts exposed to long-duration spaceflight. This began with the first joint mission, Mir-18, and continued until the final Mir-25 mission. The data indicated that loss of muscle volume, particularly in the legs and back, was greater than with short-duration spaceflight but not as great as the data from short-duration flight might have predicted.[19] A comparison between volume losses in the selected muscle groups in short-duration spaceflight on the Space Shuttle,long-duration (119 d) постельный режим, and a (115 d) Shuttle-Mir mission demonstrates the relative time course of the losses (figure 6-9).
There is good correlation between long-duration bed rest and spaceflight of similar duration except that losses in the back muscles are much less with bed rest. This likely reflects use of these muscles during bed rest to adjust body position and to reduce the potential for vascular compression and tissue injury. During spaceflight the back muscles are apparently less used because they do not have to support the upright body against Earth gravity and are not used with great force to make positional adjustments of the body as they are during the recumbency of bed rest.
Международная космическая станция (МКС)
The International Space Station's (ISS) first crew (Expedition 1) arrived in October 2000; since then there have been 15 additional Increments. The data presented here were collected during the first 11 of the ISS Expeditions.
The complexities and shortcomings of collecting scientific data from a laboratory orbiting more than 300 miles above the Earth and completing 18 orbits per day at a speed of more than 17,000 mph with discontinuous voice and data communications, combined with the constraints and limitations of up mass, crew time, and on-board logistics, cannot be overstated.

Another problem was exercise hardware that was built and launched but failed to meet science requirements. (The Resistive Exercise Device [RED] science requirement was to provide a load of up to an equivalent of 600 lbs., but the interim RED [iRED] provides only half of that amount. Ground-based studies have shown that it does produce a positive training effect similar to equivalent free weights when used in a high-intensity program,[22] but it will likely not provide sufficient load in a zero-gravity environment to prevent loss of muscle and bone tissue, as determined from parabolic flight studies.[23]) Other problems were failure at one time or another of each piece of onboard exercise hardware with reduced utilization at other times, and other limitations imposed because transmission of forces to the space frame have confounded inflight exercise sessions. In fact, during the first eleven ISS Expeditions, only for 2 short periods during Expeditions 3 and 4 were all three U.S. onboard exercise devices (Cycle Egometer with Vibration Isolation System [CEVIS], Treadmill with Vibration Isolation System [TVIS], and iRED) capable of being used under nominal conditions (Figure 6-10). The almost continuously suboptimal availability of exercise equipment likely has reduced maintenance of crew physical fitness.

Despite these shortcomings, lean tissue mass data [24] collected by means of dual-energy x-ray absorptiometry (DEXA) before and after flight compares favorably with data from NASAMir, and the total body and leg losses are in fact less than seen during NASA-Mir or during three separate постельный режим studies of similar durations in the range of 20-170 d (Figure 6-11). However, the news is not entirely good since knee extensor and knee flexor strength losses in long-duration crewmembers after flights aboard Mir and ISS[24] were ~23% and ~25%, respectively (Figure 6-12), indicating that strength losses in the quadriceps and hamstring muscle groups were significant and similar for NASA-Mir and early ISS missions, despite apparent slightly increased preservation of muscle mass (lean tissue) in the legs of ISS crewmembers compared to crewmembers on NASA-Mir missions (also Figure 6-11). These near equivalent losses occurred in spite of iRED being present on the ISS. Unfortunately, MRI data collected by Fitts and colleagues to assess skeletal muscle volumes in ISS crewmembers are not yet available to allow comparison with those from NASA-Mir. With respect to endurance, the following comparison (Figure 6-13) shows a trend for improved maintenance of muscle endurance on ISS with respect to NASA-Mir although the loss of endurance on ISS was greater than that documented during short-duration Space Shuttle missions (for ISS, n = 2).

ISS crewmembers, under the supervision of their crew surgeons, participate in a postflight exercise program implemented by certified trainers who comprise the Astronaut Strength, Conditioning and Rehabilitation (ASCR) group at Johnson Space Center. A portion of this program includes physical fitness testing on an individual basis. The results of these “functional” tests, which consist of six exercises, reveal that crewmembers return with less physical capability than when they launch but that most of the decrements are reversed by postflight day 30 secondary to the ground-based exercises the crewmembers complete in thedays after their return to Earth (Figures 14 and 15).

In this section, only the historical highlights of some highly relevant skeletal muscle investigations have been included and discussed. A complete treatment of all data would cover several volumes. However, from this brief historical overview it is possible to see how initial indications of losses in skeletal muscle function led to attempts to provide exercise countermeasures. Such countermeasures were utilized during spaceflight, crewmembers were tested upon return, and exercise regimens and equipment were modified for use in future missions. In the subsequent sections, human spaceflight and ground-based analog studies and experimental animal studies are reviewed that contribute to the evidence base on the alterations in skeletal muscle form and function that occur with the muscle unloading associated with the microgravity environment. It is this knowledge base on which future operational countermeasures and investigations into the fundamental changes in muscle physiology will be based.


Other human spaceflight
The responses of the human body to microgravity exposure during spaceflight involve adaptations at numerous levels. It is believed that skeletal muscle adaptations to microgravity, which affect both muscle mass and function, involve structural alterations in the neural as well as the myofibrillar components of skeletal muscle. It is well accepted that the muscles involved in the maintenance of an upright position in terrestrial gravity (the antigravity muscles) are the most susceptible to spaceflight-induced adaptations. This susceptibility may reflect the almost continuous levels of self-generated (active) and environmentally generated (reactive) mechanical loading to which these muscles are exposed under normal Earth gravity. Thus, effects related to the decrease in the level of mechanical loading that occurs during microgravity exposure logically would be reflected most acutely in these muscles. Changes at the structural level within skeletal muscle after spaceflight are paralleled by spaceflight-induced changes at the functional level such as decreased muscle strength and increased muscle fatigability.[10][25][26] This summary addresses nearly exclusively those investigations in which the effects of mechanical unloading on antigravity muscles were examined, and the consequent tissue remodeling at the structural and biochemical levels. Additionally, the relative success of various countermeasures is examined.
Decreases in skeletal muscle size and function have been reported since humans first began to explore space.[9][27] Spaceflight results in the loss of lean body mass as determined by body composition measurements.[19][28] Urinary amino acid and nitrogen excretion, both indirect measures of catabolism of lean body mass, are elevated during both brief [13] и долго [12][29] космические полеты. Direct measurement of protein synthesis during spaceflight using 15N-glycine incorporation as a marker revealed an increase in whole-body protein synthesis rates. These results indicated that the significant decrease in lean body mass observed after spaceflight must be associated with a significant increase in protein degradation rates [13] rather than an inhibition of protein synthesis. Decreases in lower-limb muscle circumference and calculated muscle volumes were detected in Apollo [9] and Spacelab [10] космонавты. Decreases in muscle strength, circumference, and tone have also been reported in cosmonauts.[29][30][31][32] More recently, these findings have been confirmed by direct volume measurements (by magnetic resonance imaging [MRI] of astronauts on the Space Shuttle [20][33] and of Russian cosmonauts and U.S. astronauts after tours of duty on the Mir space station.[19]
Changes in lean body mass and muscle volume are paralleled by a concomitant decrease in myofiber cross-sectional area (CSA). To date, preflight and postflight muscle biopsy samples have been obtained from only a few crewmembers. In U.S. studies, muscle biopsies were obtained before and after flight from the m. vastus lateralis of 8 astronauts after 5- and 11-day missions.[15][34][35] Notably, postflight muscle sampling was carried out within 2–3 hours of landing, which minimized the effects of reambulation on the muscle. Analysis of the muscle biopsy samples with a variety of morphologic, histochemical, and biochemical techniques indicated that the myofiber CSA was significantly decreased after spaceflight; that atrophy was greatest in Type IIB myofibers, followed by Type IIA and then Type I myofibers; that expression of Type II myosin heavy chain (MHC) protein was significantly increased, with an apparent decrease in the amount of Type I MHC protein expressed; and that the number of myonuclei per mm of myofiber length was significantly decreased in Type II myofibers after 11 days of spaceflight. In contrast to these findings, analysis of needle biopsy samples from cosmonauts, conducted by the Institute for Biomedical Problems after 76- and 180-day flights, indicated a large degree of individual variation in the extent of myofiber atrophy, with the decrease in myofiber CSA ranging from about 4% to 20%. This variation was attributed to variations in compliance with exercise countermeasures by individual cosmonauts during the flights.[36]
More recent muscle biopsy studies have indicated that despite consistent decreases in myofiber CSA in the m. soleus and m. gastrocnemius after spaceflight,[37][38][39] MHC expression does not seem to shift, as was previously described by Zhou et al.[15] This discrepancy may reflect the effects of exercise countermeasure protocols carried out by the astronauts during the later flight and the examination of muscles different from those studied in the earlier flight (gastrocnemius and soleus vs. vastus lateralis).
Decrements in the aerobic capacity of crewmembers after spaceflight, coupled with a reduction in muscle oxidative capacity, indicate that the vascular supply to skeletal muscle may also be affected by spaceflight. However, at present no consistent relationship is apparent between the degree of muscle atrophy (measured by MRI or myofiber CSA determination after muscle biopsy) and the reported changes in muscle strength and function, although typically loss in muscle strength exceeds the loss in muscle volume. The reasons for these counter-intuitive results are unclear and will probably remain so until resources become available for long-term, on-orbit study of the skeletal muscle atrophic response to spaceflight.
In addition to the effects of spaceflight on the myofibrillar component of skeletal muscle, the role of the neural components of skeletal muscle atrophy must not be understated. A functional disruption of neuronal control at the neuromuscular level,[32][40][41][42] which seems to be paralleled by a reduction in the overall electrical activity of the muscle after spaceflight,[43] raises the possibility that neuron-derived factors that play a role in the growth or maintenance of skeletal muscle may be disrupted. The hypothesis that microgravity causes a fundamental alteration in motor control has also been suggested.[44] Studies conducted at JSC by the Exercise Physiology Laboratory showed that two-legged muscle power declines considerably more than can be explained by the loss in muscle mass alone. Additionally, the loss of explosive leg power was associated with a substantial reduction in the electromyography (EMG) activity of the m. rectus femoris, m. vastus lateralis, and m. vastus medialis.[45] These investigators concluded that microgravity induced a basic change in motor control and coordination such that motor activation of extensor muscles was reduced. Similar observations have been made after long-duration spaceflight on Mir and ISS.
Evidence exists that exercise strategies are effective in attenuating muscle strength loss in bed rest. Bamman et al. preserved pre-bed rest muscle strength of the thigh and calf in subjects who performed resistive exercise with loads equivalent to 80-85% of their pre-bed rest strength (1-RM).[46][47] Protection of muscle volume occurred through the maintenance of protein synthesis, which also likely influenced muscle strength.[48] Similarly, Akima et al. were able to maintain isometric peak torque in subjects who performed daily maximal isometric contractions of the knee extensors during 20 days of bed rest.[49] Using an aggressive resistive exercise training protocol, Shackelford et al. preserved isokinetic muscle strength and observed substantial increases in isotonic muscle strength over the course of 89 days of bed rest [50] in exercising subjects. Using a flywheel resistive exercise device, Alkner and Tesch prevented the loss of muscle mass and strength in the thigh and attenuated the losses in the calf.[51]
The similarity in skeletal muscle responses during spaceflight and bed rest were elegantly demonstrated by Trappe and colleagues [39] in a combined 17-day spaceflight study of 4 crewmembers and a 17-day bed rest study of 8 test subjects. In all of these subjects, assessment of muscle fiber size, composition, and in vivo contractile characteristics of the calf muscle were completed. Protocols and timelines for the two studies were identical, which allowed direct comparisons between a spaceflight and a bed rest study of equivalent duration. Calf muscle strength was measured before and on days 2, 8, and 12 of spaceflight and bed rest as well as on days 2 and 8 after spaceflight and bed rest in the two investigations. Muscle biopsies were obtained before and within 3 hours after spaceflight (m. gastrocnemius and m. soleus) and bed rest (m. soleus) just before reloading. After 17 days of spaceflight or bed rest, no significant measurable changes occurred in maximal isometric calf strength, force-velocity characteristics, myofiber composition, or volume in the calf muscles studied. Since loss of skeletal muscle strength is an expected finding in both spaceflight and bed rest, the investigators concluded that the testing protocol utilized during both studies must have provided sufficient resistance exercise to prevent losses in muscle strength and changes in morphology.
Some general conclusions that can be drawn from the data gathered from astronaut/cosmonaut studies are as follows. First, loss of muscle mass is most prevalent in the antigravity muscles such as the soleus; second, the atrophic response to short-term spaceflight does not seem to be specific to myofiber type; and third, myosin heavy chain (MHC) isoform expression does not seem to shift from Type I MHC to Type II during short (< 18-day) spaceflights.
Ground-based analog studies
Several ground-based paradigms have been used to emulate the effects of microgravity unloading on human skeletal muscle, including complete horizontal or 6° head-down-tilt постельный режим, dry immersion, and unilateral upper- and lower-limb unloading with or without joint immobilization. In general, skeletal muscle responses to unloading have been similar in all of these models. Although no perfect simulation of crew activities and the microgravity environment can be adequately achieved, Adams and colleagues have suggested that bed rest is an appropriate model of spaceflight for studying skeletal muscle physiologic adaptations and countermeasures.[1]
Bed rest unloading causes a significant loss of body nitrogen and lean body mass.[21][52][53] A reduction in the size or volume of the ambulatory muscles accounts for most of the decrease in lean body mass after bed rest.[21][54] This decrease correlates with a significant reduction in muscle protein synthesis.[48][52] Horizontal and 6° head-down-tilt bed rest protocols of various durations (7 days, 14 days, 30 days, 5 weeks, or 17 weeks) have resulted in significant reductions in lower-limb muscle volume as measured by MRI, ranging from a 30% loss in the ankle extensor muscles [21] to a 12% loss in the plantar flexors (gastrocnemius and soleus).[55] Decreases in muscle volume after bed rest were paralleled by decreases in muscle strength and endurance, as evidenced by significant decreases in angle-specific torque,[56] isokinetic muscle strength,[21][57] and fatigability.[58] Similar losses in muscle volume, paralleled by decreases in muscle strength and endurance, have been observed after unilateral lower-limb suspension.[57][59][60] Dry immersion, a whole-body-unloading paradigm with the added advantage of mimicking the reduced proprioceptive input encountered during spaceflight, also brings about reductions in muscle volume, strength, endurance, electrical activity, and tone.[30][61][62][63][64][65][66]
At the structural level, the loss of muscle volume in these models correlates with a significant decrease in CSA of both Type I and Type II myofibers.[46][60][67][68][69] In general, Type II myofibers seem to be more likely to atrophy than do Type I myofibers during short-term unloading, with no significant myofiber type shifting being observed,[46][47][67] although alterations in total muscle MHC protein isoform expression have been reported.[70] However, prolonged bed rest (greater than 80 days) does significantly change the number of MHC hybrid fibers observed in the soleus muscle.[71] Immobilization by limb casting does not seem to reduce the relative proportions of muscle-specific proteins, such as carbonic anhydrase II and myoglobin, over that predicted by the overall decrease in muscle protein synthesis.[72] In contrast, experimental evidence suggests that the specific activity of muscle enzymes involved in oxidative metabolism, such as pyruvate dehydrogenase, is decreased by cast immobilization.[73] A similar reduction in the activity of citrate synthase, but not phosphofructokinase, has been detected in the vastus lateralis, indicating a significant impairment of the oxidative capacity in this muscle after unilateral limb suspension.[74] The differences observed between cast immobilization and unilateral limb suspension or bed rest protocols may reflect the former being a better model of muscle atrophy induced by hypokinesia and the latter two being better models of muscle atrophy induced by muscle hypodynamia. The latter situation more closely resembles the actual conditions experienced by crewmembers during spaceflight, namely removal of mechanical loading without a reduction in limb mobility. However, it is apparent that although ground-based unloading models are useful in studying the effects of microgravity on skeletal muscle, no single terrestrial model system produces all the physiological adaptations in skeletal muscle observed as a consequence of spaceflight.[1] Absent from human analog studies are the unique operational and psychological stressors associated with spaceflight that exacerbate the physiological changes resulting from muscle unloading.[75]
Again, the decreases in muscle volume and myofiber CSA observed in these ground-based analogs of spaceflight bring about changes in the neuronal-activation patterns of the unloaded muscles, including decreased electrically evoked maximal force,[76] reduced maximal integrated electromyography,[57] and neuromuscular junction dysfunction.[77] Certainly such decreases in the neural drive in unloaded muscle play a role in the atrophic response.
As in spaceflight, adaptations to unloading can be observed after short-duration bed rest. For example, after 20 d of bed rest, volume of quadriceps muscle decreased by 8%, hamstrings decreased by 10%, and plantar flexor muscles were reduced by 14%.[49] During a longer, 89-d bed rest, greater reductions in muscle volume in the quadriceps (-15%), hamstrings (-13%), soleus (-29%), and gastrocnemius (-28%) were reported.[50] In a 90-day bed rest trial,[78] a 26% ± 7 decline in the CSA of the calf muscle was observed. This rate of decline is consistent with earlier measurements in which after 90 days of bed rest, a roughly 15% decline in quadriceps and hamstring muscle volume measured by MRI scans were noted in two subjects.[19] Reductions in muscle strength were also demonstrated in these studies.
Bamman and colleagues observed losses of 18, 17, and 13% in concentric, eccentric, and isometric plantar flexor peak torque, respectively, after 14 d of bed rest,[46] and Akima and his co-investigators observed a 16% decrease in knee extensor isometric torque after 20 days of bed rest.[49] Although not specifically reported, subjects in an 89-day bed rest trial [50] experienced significant reductions in isokinetic torque in the lower body, with the greatest losses in the knee extensors (-35%). This study also used isotonic testing (1RM), and mean losses ranging from -6 to -37% were observed; reductions in adductor, abductor, and leg press strength were on the order of ~25-30%.[50] In an earlier 90-day bed rest trial, LeBlanc and colleagues observed losses of 31% in knee extension strength and 15% in knee flexion strength.[21] Few studies have reported changes in the ab/adductor or the flexor/extensor muscles of the hip. Shackelford et al. reported that isotonic strength decreased by about 25% in the adductors, but only a 6% decrease in the hip flexors was demonstrated after 17 weeks of bed rest.[50] After 55 days of bed rest, Berg et al. reported that a 22% reduction in isometric hip extension occurred, although the extensor muscles in the gluteal region decreased in volume by only 2%.[79] The authors reported no explanation for this discrepancy between the proportion of reduced strength relative to the loss of mass, and also stated that no previous studies in the literature had made these concurrent strength/volume measurements in the hip musculature.
Some general conclusions that can be drawn from the above human studies are as follows. First, terrestrial unloading models produce selective atrophy in the muscles of the lower limbs, especially the anti-gravity muscles; second, this response is greater in the extensor muscles than in the flexor muscles; third, muscle atrophy occurs quickly (within 7–14 days) in response to unloading; fourth, loss of muscle mass is paralleled by decrements in muscle strength and endurance, but strength losses typically are greater than volume losses; fifth, if atrophy is specific to a myofiber type within these muscles, it seems to be Type II myofibers; and sixth, terrestrial unloading does not seem to produce a slow-to-fast shift in absolute myofiber characteristics but does alter the expression of MHC isoforms in human muscle so that an increase in MHC hybrid myofibers is observed, resulting in a faster phenotype.
Other research findings exist that relate peripherally to this risk description that should remain associated with it. The physical inactivity and muscle unloading occurring in association with spaceflight can result in a decrease in muscle mass, which in turn may be associated with an increased susceptibility to insulin resistance (glucose intolerance). While this association is quite clearly documented in bed rest studies, the association is not yet solidified for spaceflight. Additionally, the major countermeasure to muscle atrophy is exercise, and it should be appreciated that crewmembers chronically exposed to the microgravity environment may develop impaired body temperature regulation during rest and exercise that may lead to heat strain and injury. These are discussed more fully in the paragraphs that follow.
After short-duration spaceflights, Soviet cosmonauts were observed to have elevated serum insulin levels that persisted up to 7 d after landing.[80][81] In the first 28 U.S. Space Shuttle flights (2-11 d duration), serum insulin levels (n = 129) were elevated by 55% on landing day compared to before flight.[82] Russian space life science investigators reported two-fold or greater increases in insulin levels in three cosmonauts within 1 day after they returned from a 237-d flight.[83] The associated finding of elevations in both insulin and blood glucose (12% on landing day compared to preflight levels in 129 Space Shuttle crewmembers on flights of 2-11 d duration) may indicate an acquired decreased tissue sensitivity to insulin associated with spaceflight. Ground-based bed rest studies [84][85] simulating weightlessness in humans have shown an increased insulin response to glucose tolerance tests. In such studies, plasma insulin levels have increased up to four-fold compared to those of control subjects, and blood glucose levels exceeded those of the controls 2 h after glucose loading. In a well-designed 7-d bed rest study, insulin action on both whole-body glucose uptake rate and leg glucose uptake rate was investigated. It was concluded that the inactive muscle of bed rested subjects was less sensitive to circulating insulin. However, in a study of four Space Shuttle astronauts by the same investigators,[86] in which glucose tolerance tests were performed 15 d before launch, on flight day 7, and on postflight days 2 and 15, increases in the concentrations of insulin, glucose, and Cpeptide in in-flight samples were observed, but the changes were not significantly different from the preflight and postflight values. The investigators concluded that 7 d of spaceflight did not confirm the assumption that microgravity exposure leads to impaired glucose tolerance. However, the brief (7 d) exposure to microgravity may have been insufficient in duration to induce statistically significant changes, and thus additional studies on crewmembers from long duration missions are needed to confirm these findings.
Human expenditure of energy results in the generation of heat. The body heat generated by normal activities, and particularly by exercise, triggers homeostatic regulatory mechanisms with the goal of maintaining body core temperature within its relatively narrow, safe physiologic range by means of vasoregulation and diaphoresis. The weightlessness environment of spaceflight may impair heat dissipation by reducing evaporative and conductive heat exchange. Microgravity and spaceflight may perturb the body's thermoregulatory mechanisms by altering the work efficiency, metabolic rate, or circadian rhythms of heat production. Additionally, human space travelers are often not well hydrated, have a 10-15% decrease in intravascular fluid (plasma) volume, and may lose both their preflight muscular and cardiovascular fitness levels as well as their thermoregulatory capabilities. As a result, they may become less heat-acclimated or may acquire an altered thermal sensitivity.[87]
Alterations in thermoregulation in association with spaceflight could significantly affect a variety of spaceflight-associated activities including exercise as a countermeasure to muscle atrophy, cardiac deconditioning, and bone loss; extravehicular activity (EVA); and vehicle landing and egress. EVA suits and launch and entry or advanced crew escape suits (ACES) worn by ISS and Shuttle crewmembers are designed to provide an impermeable barrier between the wearer and the external environment. To compensate for lack of heat exchange through the fabrics of these suits, the EVA suit provides both liquid (conductive) and air (convective) cooling, while a liquid cooling garment is worn under the ACES in addition to a hose connection to forced orbiter cabin air. Thus, crewmembers with altered thermoregulatory capabilities are at even greater risk should failure of the cooling systems of these garments occur.[88] Manifestations of altered thermoregulation include increased heart rate and body temperature during exercise, decreased work capacity and endurance, decreased postflight orthostatic tolerance, decreased cognitive ability, and a delay in recovery of exercise capacity and endurance after flight.[89]
Thermoregulation has been studied in association with both spaceflight[89][90] and 6° head-down-tilt bed rest.[90][91][92] To date, there have been no direct measurements of heat balance during in-flight exercise sessions. In the only spaceflight study, submaximal exercise and thermoregulatory responses were recorded before flight and at 5 d after landing in two crewmembers who completed a 115-d mission.[89] Normal heart rates were observed for both crewmembers during supine exercise for 20 min each at 20% and 65% of VO2max. However, during postflight (five days after landing) testing, exercise was voluntarily discontinued after only 8-9 min of supine exercise at the 65% of VO2max level for the two crewmembers when they both experienced difficulty in maintaining pedaling frequency and complained of leg fatigue, and their heart rates exceeded the highest recorded preflight levels. Both crewmembers exhibited a more rapid increase in body core temperature during the shorter postflight exercise session than during the preflight session; it was concluded that heat production was not altered but that impairment of heat dissipation due to altered vasodilatory and sweating responses were responsible for the increased rate of rise in the core body temperature.
Adequate energy (caloric) intake is a necessary requirement for humans living and working in space, and much attention has been focused on this requirement. Less effort has been spent on understanding how the caloric heat generated by energy expenditure is handled by humans whose physiologic responses to heat may be altered in the unique physical environment of spaceflight. Such studies should be considered at a higher level of priority for future human space missions. Recently applied models [88] may be of use in providing a better understanding of the magnitude of this associated risk.
Experimental animal studies
В этом разделе резюмируются исследования, проведенные на животных (таких как грызуны и нечеловеческие приматы), которые подверглись либо космическому полету, либо (в случае грызунов) хорошо принятому наземному аналогу подвешивания задних конечностей. (HS), чтобы выяснить влияние состояний разгрузки на свойства мышечной массы, силы и выносливости. Представленные здесь результаты в подавляющем большинстве подтверждают совокупность доказательств, которые были представлены на людях в предыдущих разделах этого отчета. Важно отметить, что благодаря использованию большего количества клеточных и молекулярных анализов было получено более глубокое понимание основных механизмов, связанных с этими изменениями в структуре и функции мышц. Поскольку большинство данных о влиянии космического полета на скелетные мышцы млекопитающих было получено из исследования грызунов, представленная здесь информация в основном ориентирована на модель грызунов. Важно отметить, что структура и функция скелетных мышц грызунов почти идентичны скелетным мышцам человека. Например, мышца грызунов состоит из того же общего профиля типа волокон и чувствительна к тем же факторам окружающей среды (механическим, гормональным, метаболическим), которые наблюдаются для мышц человека. Таким образом, приведенная ниже информация обеспечивает надежность базы данных, полученной от людей. Однако важно отметить, что одно из основных преимуществ модели грызунов состоит в том, что адаптивные изменения, которые происходят у обоих видов, у грызунов происходят в гораздо более короткие сроки, чем у людей (часы или дни, а не дни или недели), что делает возможным для прогнозирования долгосрочных изменений в скелетных мышцах человека на основе более коротких абсолютных временных рамок исследований, проведенных на грызунах. Еще одно важное соображение в контексте исследований на животных во время космического полета заключается в том, что можно провести простой эксперимент, в котором нет необходимости обеспечивать какой-либо тип контрмеры, как для людей, и тем самым можно избежать введения смешивающей переменной при установлении истинное влияние космического полета на широкий круг физиологических переменных. Кроме того, учитывая замечательное согласие в количественном и качественном характере результатов, наблюдаемых в исследованиях космических полетов, по сравнению с данными, полученными в ходе наземных исследований HS, мы решили объединить и интегрировать значительную часть данных, которые были собраны за последние 25 лет. годы. Эта база данных по грызунам в исследованиях космических наук о жизни включает 14 летных экспериментов, из которых 8 спонсируются программой Russian Cosmos, а 6 - миссиями NASA Space Life Sciences (SLS) и космической транспортной системы (STS).[93] Эти летные эксперименты дополняются многочисленными наземными исследованиями, которые в совокупности сосредоточены на темах, описанных ниже. Наиболее важно то, что все данные, представленные в этом резюме, получены для когорт животных, в которых контрольные животные изучались из группы синхронного вивария того же возраста, линии и пола, и анализ проводился одновременно с анализом экспериментальные группы. Предоставленная информация полностью основана на рецензируемых экспериментах, как подробно описано в предоставленной библиографии.
Образцы активности во время космического полета
Хотя зарегистрированные наблюдения во время космического полета у грызунов менее обширны (из-за меньшего количества полетов с возможностью наблюдения за ними астронавтами или специалистами по полезной нагрузке), имеющиеся данные позволяют предположить, что грызуны меньше полагаются на задние конечности для выполнения большинства движений (как в случае с люди). Во время космического полета их лодыжки, кажется, принимают положение подошвенного сгиба, которое может уменьшить пассивное напряжение (силу), воздействующее на группу трехглавой мышцы бедра, главным компонентом которой является антигравитационная медленно сокращающаяся камбаловидная мышца.[94] Похожая поза наблюдалась в наземном аналоге HS. Считается, что эта поза влияет на остаточное напряжение, прикладываемое к этой группе мышц при отсутствии нормального состояния нагрузки, то есть группа мышц подошвенного сгибателя голеностопного сустава становится действительно разгруженной. В то время как электромиографические исследования взрослых грызунов не проводились во время космических полетов, исследования, проведенные на грызунах во время хронической ГВ, показывают, что только временное снижение электрической активности подошвенных сгибателей голеностопного сустава (камбаловидной и медиальной икроножных мышц) происходит.[95] Этот образец активности соответствует положению мышц и поддержанию мышечной массы в течение 28-дневного периода эксперимента. То есть активность ЭМГ сохранялась, в то время как продолжающаяся атрофия сохранялась. Эти данные подтверждают мнение о том, что для поддержания физиологического гомеостаза важна механическая активность, а не электрическая активность, воздействующая на мышцу.
Модели активности при раннем восстановлении после космического полета
Когда животные возвращаются из космического полета даже на короткое время (дни), их основные модели активности изменяются. Центр тяжести у крыс намного ниже обычного. Они больше не поддерживают вес своего тела и начинают движение подушечками стоп, а голеностопный сустав принимает чрезмерно согнутое тыльное положение.[94] Движение при большинстве произвольных действий происходит намного медленнее и более осознанно (животные преодолевают меньшие расстояния за единицу времени), и животные проводят значительно меньше времени в положении на двух ногах.[94] Кроме того, по наблюдениям исследователей, грызуны в большей степени используют свои хвосты для основной поддержки. Таким образом, двигательные навыки грызунов и базовые двигательные способности имеют меньшую точность и способность сохранять осанку и двигаться на ранних стадиях восстановления; однако через 9 дней после полета свойства активности возвращаются к тем, которые наблюдаются в нормальных условиях.
Влияние космического полета и подвешивания задних конечностей на мышечную массу, содержание белка и общие морфологические свойства скелетных мышц
Накоплен значительный объем информации, охватывающий большое количество космических полетов и экспериментов по HS, которые охватывают период времени от ~ 4 до 22 дней для космического полета и от 1 до 56 дней для HS. Эти эксперименты в первую очередь были сосредоточены на мышцах-разгибателях, широко используемых для поддержки позы и двигательной активности. Обзор Роя, Болдуина и Эдгертона представляет собой один из наиболее полных обзоров грызунов в космической среде.[96] Опубликованы дополнительные обзоры по этой теме.[96][97][98][99][100][101] Коллективные наблюдения ясно показывают, что эти типы мышц претерпевают значительное сокращение мышечной массы (мышечной массы).[94][96][100][102][103][104][105][106][107][108][109][110][111][112][113][114] Наряду с сопутствующей потерей общего белка и миофибриллярных (фракция, которая состоит из сократительного аппарата структурных белков) содержание белка в целевых мышцах.[97][103][115][116] В некоторых экспериментах сообщалось, что миофибриллярная фракция может разрушаться в большей степени, чем другие мышечные фракции.[103] Общая картина демонстрирует, что быстрая потеря мышечной массы и чистого общего и миофибриллярного содержания белка (концентрация (мг / г X мышечной массы) происходит в течение первых 7-10 дней разгрузки, после чего следует более постепенная потеря этих компонентов. .[93][101] Конечный результат состоит в том, что от 25 до 46% мышечной массы может быть потеряно в антигравитационных мышцах нижней конечности, таких как камбаловидная мышца (Sol; икроножная мышца) и обширная промежуточная мышца бедра (VI; глубокослойная четырехглавая мышца), которые являются состоит в основном из медленных миофибрилл I типа, содержащих белок медленной тяжелой цепи миозина (MHC). MHC - самый распространенный белок, экспрессируемый в поперечно-полосатых мышцах; и этот структурный / регуляторный белок служит моторным белком, который в синергии со своим сопутствующим белком актином регулирует процесс сокращения, который обеспечивает силу, работу и выработку энергии, которые необходимы мышечным группам для обеспечения движения и стабилизации. активности (позы). Также важно отметить, что быстро сокращающиеся синергические мышцы (экспрессирующие быстрые изоформы MHC) также нацелены, но эти мышцы и их волокна, по-видимому, не так чувствительны к стимулу разгрузки, как более медленные типы мышц. По сравнению как с медленными, так и с быстрыми типами мышц, атрофия соответствующих сгибателей суставов, например, передней большеберцовой мышцы и длинного разгибателя пальцев ноги, значительно меньше.[96]
Гистохимический и иммуногистохимический анализы на уровне отдельных волокон ясно показывают, что атрофический процесс, наблюдаемый на общем уровне, происходит из-за уменьшения диаметра пораженных миофибрилл, из которых состоят отдельные мышцы. Эти наблюдения показывают, что волокна медленного типа более чувствительны, чем волокна более быстрого типа, что согласуется с определениями общей мышечной массы.[96][112][116][117] Как правило, независимо от мышцы, более крупные волокна, быстрые или медленные, более чувствительны к разгрузочному стимулу, чем их меньшие аналоги.[96]
Ремоделирование фенотипа мышечных волокон в ответ на космический полет и подвешивание задних конечностей
Процесс атрофии, отмеченный выше, сопровождается важными наблюдениями, согласно которым многие (но не все) медленные волокна в мышцах преимущественно антигравитационного типа (такие как SOL и VI) также индуцируются для экспрессии быстрых изоформ миозина.[104][105][116][118][119][120] Эта трансформация в значительной степени проявляется в экспрессии гибридных волокон, в которых одновременно коэкспрессируются как медленный MHC, так и быстрый тип IIx или быстрый тип IIa.[105][112] Эти наблюдения предполагают, что медленный MHC нацелен на деградацию, о чем свидетельствует чистая потеря медленных MHC в атрофирующихся мышцах (волокнах),[93][103] в то же время, согласно анализу премРНК и мРНК, происходит активация более быстрых генов MHC посредством транскрипционных и / или претрансляционных процессов.[116][121][122] Более поздние исследования по этой теме ясно показывают, что MHC типа IIx, который является более быстрой изоформой, чем тип IIa, экспрессируется более широко. Из этих наблюдений очевидно, что миофибриллярная фракция, которая является ключевым компонентом мышцы, нацелена на чистую деградацию (как отмечено выше) по двум причинам:
- деградация этой фракции позволяет проявиться волокнам меньшего диаметра для удовлетворения пониженных требований к генерации силы, и
- Распад миофибриллярной системы позволяет более быстрым изоформам MHC включаться в сократительный механизм, чтобы заменить более медленные, так что мышца может функционировать более эффективно в условиях пониженной гравитационной нагрузки.
Дальнейшее понимание дает наблюдение, что состояние разгрузки в космическом полете и HS также увеличивает экспрессию быстрого кальциевого насоса саркоплазматического ретикулума (SR) типа II, управляемого АТФазой (SERCA II), одновременно подавляя более медленный кальциевый насос SERCA типа I.[123] Поскольку кальциевый цикл используется для регулирования активации и расслабления волокон, компонент SR мышечного волокна контролирует синхронность процессов сокращения-релаксации. Поскольку кальциевый цикл и кроссбридж - две основные системы, на которые приходится подавляющее большинство энергии, расходуемой во время сокращения мышц для поддержки движения, когда это свойство мышцы переключается на более быструю систему, мышца может функционировать более эффективно в ненагруженной среде. . Однако, когда мышца сталкивается со средой с сильным гравитационным стимулом, более быстрые свойства по своей природе менее экономичны в противодействии силе тяжести, и, таким образом, мышечные волокна становятся более утомляемыми при сокращении против нагрузки в течение длительного времени.[105]
Метаболические процессы
В отличие от сократительного аппарата, исследования различных метаболических ферментов скелетных мышц грызунов выявили различные реакции без явных адаптивных изменений в экспрессии окислительных ферментов.[96][111][112][124] Эти наблюдения согласуются с результатами исследований, посвященных функции митохондрий после 9 дней космического полета, в которых не было снижения способности митохондрий скелетных мышц метаболизировать пируват (производное углеводов). [102] наблюдалось. Эти анализы проводились в условиях метаболизма состояния 3, то есть при неограниченных количествах субстрата и кофакторов для моделирования потребности в обмене энергии, аналогичной потребности в высокоинтенсивных упражнениях.[102] Однако при испытании субстрата жирной кислоты наблюдалось снижение способности различных типов мышц окислять длинноцепочечную жирную кислоту, пальмитат.[98] Это последнее открытие согласуется с наблюдением, что мышцы, подвергшиеся космическому полету, увеличивают уровень запаса липидов в их миофибриллах.[111] Кроме того, использование метаболического пути для поглощения глюкозы в мышцах, подвергающихся ГВ, увеличивается.[96] Таким образом, хотя данные по ферментам неоднозначны, похоже, что в ответ на состояния разгрузки может произойти некоторый сдвиг в предпочтении субстратов, в результате чего углеводы предпочтительно утилизируются в зависимости от способности утилизации. Если это действительно так, это может привести к большей тенденции к мышечной усталости, если запасы углеводов станут ограниченными во время длительных приступов активности EVA.
Функциональный коррелирует с изменениями мышечной массы и сократительного фенотипа в ответ на космический полет.
Стивенс и соавторы [125] сообщили, что в отдельных анализах отдельных волокон были обнаружены дефициты способности генерировать силу наряду со сниженной чувствительностью к стимуляции кальцием. Подобные наблюдения наблюдались как для медленных, так и для быстрых волокон разгибателей голеностопного сустава после 14 дней космического полета. В этом исследовании основное внимание уделялось силовым аспектам мышечных волокон. Похоже, что было проведено только два дополнительных исследования для изучения влияния космического полета на функциональные свойства скелетных мышц грызунов с использованием более полного набора анализов. Один проект реализован за 6 дней [104] а другой - двухнедельный полет (SLS-2).[105] В обоих исследованиях измерения были сосредоточены на силово-скоростных свойствах, которые определяют пределы функциональной способности мышцы. Эти исследования были проведены на скелетной мышце камбаловидной мышцы, в которой преобладают медленно сокращающиеся миофибриллы из-за динамических изменений морфологии и фенотипа волокон, которые наблюдались в других исследованиях, обобщенных выше. Анализы на животных были начаты в течение 6 часов после возвращения из космического полета. Полученные данные показали, что максимальная сила мышцы, измеренная на месте с использованием компьютерной системы эргометра, снизилась на 24% после 6-дневного полета и на 37% после 14-дневного полета.[105] Эти изменения соответствовали степени атрофии, наблюдаемой как на макроуровне, так и на уровне отдельных миофибрилл. Кроме того, произошли сдвиги в частотно-силовой реакции камбаловидной мышцы у летающих животных, что указывает на переключение на более быстрый сократительный фенотип. Максимальные скорости укорочения были увеличены на 14% и 24% в группах 6-дневного и 14-дневного космических полетов соответственно. Такое внутреннее увеличение скорости укорочения отчасти объясняется экспрессией de novo быстрого типа IIx MHC во многих медленных мышечных волокнах. С другой стороны, как рабочие, так и энергетические возможности атрофированных мышц, вызванных полетом, были значительно снижены. Кроме того, было значительно снижено сопротивление утомлению, а также способность поддерживать работу и выходную мощность в соответствии с парадигмой, включающей повторяющиеся выходные сокращения.[105][126] Подобные результаты были получены при использовании сопоставимых аналитических подходов с использованием модели HS.[117][118][119][120][127] Взятые вместе, результаты ясно указывают на то, что когда скелетные мышцы, особенно те, которые имеют большую долю медленных миофибрилл, подвергаются атрофии и ремоделированию сократительного фенотипа, функциональная способность мышцы снижается вместе с ее способностью поддерживать производительность. Если бы достаточная масса мышечной ткани в нескольких ключевых группах мышц была затронута аналогичным образом, это, скорее всего, ухудшило бы физическую форму человека при выполнении сценариев упражнений средней интенсивности.
Атрофированные мышцы уязвимы для травм
Райли и партнеры [94][113][128] предоставили превосходный синопсис структурной целостности мышц млекопитающих на ранних стадиях после возвращения из космического полета. Их результаты показывают, что в атрофированных медленных типах скелетных мышц нет доказательств повреждения волокон, когда мышцы взяты у животных, подвергнутых эвтаназии и обработанных во время космического полета. Однако наблюдения показывают, что в течение первых 5-6 часов после космического полета (самая ранняя временная точка, в которую можно попасть к животным), возникает отек в целевых антигравитационных мышцах, таких как камбаловидная мышца и длинная приводящая мышца (AL).[94] Считается, что это происходит из-за увеличения притока крови к мышцам, когда они изначально перезаряжаются против силы тяжести. Кроме того, в определенных областях AL есть некоторые признаки повреждения волокон, основанные на гистологическом анализе целостности миофибрилл и выравнивания белков в саркомере. Хотя эти наблюдения были отмечены в ~ 2,5% волокон AL, они не присутствовали в камбаловидной мышце. Райли предположил, что причина разницы в реакции между двумя группами мышц заключается в том, что ослабленные животные изменили свою позу и походку, так что на AL оказывается эксцентрическое напряжение, что приводит к повреждению волокон. Отек и повреждение волокон не были отмечены в другой когорте животных, изученных через 9 дней после приземления.[94] Однако в дополнительных исследованиях, проведенных как на космических полетах, так и на грызунах HS [113][128] в котором до анализа мышц давали пройти от 12 до 48 часов, наблюдения показали, что нормальная активность клетки вызвала значительные повреждения в мышцах после того, как было разрешено достаточное повторное перемещение. К ним относятся эксцентрично-подобные поврежденные саркомеры, миофибриллярные разрывы, отек и свидетельства активации макрофагов и инфильтрации моноцитов (известные маркеры процессов восстановления травм в мышцах) в целевых миофибриллах.[113]
Вывод из этих выводов состоит в том, что действительно существует склонность к мышечным травмам, вторичным по отношению к атрофическому процессу, который ослабляет мышцы, и, учитывая нестабильность животного после космического полета, как описано выше, наиболее вероятно, что существует вероятность травмы, если стрессовые стимулы налагается на мышечную систему, прежде чем она сможет восстановить свои надлежащие структурные и функциональные возможности.
Клеточные и молекулярные механизмы атрофии мышц в ответ на разгрузочные стимулы
Как указано выше, атрофия скелетных мышц включает дисбаланс между процессами, контролирующими синтез белка (также известными как трансляция белка), и процессами, контролирующими распад белка. Когда два процесса работают синхронно, мышечная масса стабильна. Однако, если есть дисбаланс, такой, что путь синтеза белка снижен относительно скорости деградации, произойдет атрофия мышц. В случае атрофии скелетных мышц в ответ на космический полет или HS, кажется, происходит снижение способности к синтезу, а также усиление процессов, регулирующих деградацию, что создает быструю чистую деградационную реакцию на стимул разгрузки. На основе имеющейся информации такой сценарий предполагает следующую цепочку событий. В начале разгрузки с участием широкого спектра моделей, включая космический полет, в скелетных мышцах происходит снижение транскрипционной и / или пре-трансляционной активности, что влияет на гены MHC типа I и IIa. [121] а также ген актина.[122] Это приводит к снижению уровня пулов пре-мРНК и мРНК (последний является субстратом для трансляции белков) для этих трех белков. Вместе MHC и актин обеспечивают основную часть миофибриллярной фракции, на которую приходится большая часть белка в мышечной клетке. Одновременно происходит снижение активности ключевых ферментных систем протеинкиназ (составляющих путь PI3kinase / akt / mTOR), которые регулируют аппарат синтеза белка, контролирующий трансляцию белка.[129][130] Это изменение в сочетании с меньшим количеством субстрата мРНК в совокупности способствует снижению чистой способности к синтезу белка. Одновременно с этим процессом происходит активация набора генов, кодирующих белки, которые играют регулирующую роль в усилении деградации белков. К ним относятся ген миостатина,[129][130] то атрогин 1 ген,[129][130] и ген, называемый мышечным белком безымянного пальца, называемый MURF.[130] Миостатин - это фактор транскрипции, препятствующий росту, который, как считается, отрицательно модулирует гены, способствующие росту. Атрогин и MURF представляют собой лигазы E3, которые отвечают за убихинирование целевых белков, чтобы пометить их для деградации в системе, обозначенной как протеасома. Сообщается, что этот белок MURF является ключевым регулятором для специфического воздействия на расщепление белков MHC типа I и типа IIa.[131]
В результате снижения чистой способности к синтезу белка и увеличения деградации белка происходит чистая потеря мышечного белка в мышечных волокнах вместе с изменением относительной доли содержания белка MHC, поскольку имеющиеся данные показывают, что во время мышечной атрофии активируются более быстрые гены MHC.[121] Следовательно, это приводит к меньшему и более быстрому мышечному фенотипу, который, по-видимому, больше подходит для работы мышц в состояниях разгрузки. Цепочка событий, описанная выше, должна быть притуплена или обращена вспять, если мышца должна работать оптимально при столкновении с усиленным гравитационным стимулом при возвращении на Землю или переходе от низкой гравитации (микрогравитация) к более высокой гравитационной среде, такой как посадка на Луну или Марс. Очевидно, что лучшая стратегия для выполнения этой задачи - это программа энергичных контрмер, которая обеспечивает высокий уровень механического стресса для предотвращения дисбаланса в экспрессии белка, который возникает, когда мышца недостаточно нагружена в течение значительных периодов времени без вмешательства анаболического стимула.
Воздействие космического полета на нечеловеческих приматов
Насколько нам известно, единственный другой вид, помимо крысы, который участвовал в космических исследованиях скелетных мышц, - это макака-резус. Две обезьяны летали в космос в течение 14 дней на спутнике Bion 11. Их сравнивали с контрольными животными наземного вивария, а также с группой, ограниченной стулом, которая включала иммобилизацию плеча и плеча. Результаты этих исследований позволили сделать следующие выводы. Отдельные волокна (медленные и быстрые) обезьяны проявляли функциональные свойства, которые были более близки к человеческим волокнам, чем к волокнам грызунов, в том смысле, что волокна были больше, но менее мощны на единицу площади поперечного сечения, чем волокна грызунов.[132][133] Однако при анализе отдельных волокон до и после полета медленные волокна как в медленно сокращающейся камбаловидной, так и в трехглавой мышцах подверглись большей атрофии и уменьшению силы и выработки энергии, чем быстро сокращающиеся волокна. Кроме того, трансформации в профиле тяжелой цепи миозина показали, что в двух разных группах мышц был более высокий уровень гибридных медленных / быстрых волокон.[133][134] Иммобилизация группы трехглавой мышцы вызвала аналогичные реакции, но величина изменений была намного меньше, чем у космических животных.[134]
Дополнительные эксперименты, проведенные на этих же животных, включая двигательную активность до и после космического полета с помощью электромагнитных импульсов в мышцах и регистрации силы сухожилий, соответственно, продемонстрировали, что постуральный и локомоторный контроль был нарушен космическим полетом, как это наблюдалось у людей.[135] Эти изменения в основном проявлялись в модифицированных сигналах, связанных с нагрузкой, что отражалось в измененном относительном смещении рекрутирования мышц-сгибателей по сравнению с разгибателями и пулов быстрых и медленных двигательных единиц. В дополнительном исследовании полета (рейс 2229 Cosmos) с участием двух макак-резусов записи ЭМГ были получены до, во время и после космического полета.[136] Эти эксперименты были уникальны тем, что записи, полученные во время космического полета, показали предпочтительный сдвиг в моделях рекрутирования в пользу быстрой медиальной икроножной мышцы по сравнению с ее синергетической медленной камбаловидной мышцей, то есть нормальная картина рекрутирования была обратной; и это изменение сохранялось на стадии восстановления после космического полета, что дополнительно указывает на реорганизацию нейромоторной системы во время и сразу после воздействия микрогравитации.
Таким образом, очевидно, что волокна скелетных мышц людей, обезьян и грызунов имеют сходные паттерны изменений миофибрилл, которые, в случае обезьян и людей, также связаны с изменением двигательной активности в ответ на различные состояния разгрузки, сокращение использования, и вернуться в гравитационную среду Земли.
Информация компьютерного моделирования
Насколько нам известно, на сегодняшний день в литературе нет соответствующих ссылок, в которых компьютерное или цифровое моделирование использовалось для прогнозирования потери массы и функции скелетных мышц в условиях микрогравитации или для прогнозирования эффективности контрмер у экспериментальных животных или люди. Тем не менее, существует попытка разработать такую симуляцию, получившую название «Цифровой астронавт».[137] Цифровой астронавт описывается как «интегрированная модульная система моделирования и базы данных, которая будет поддерживать космические биомедицинские исследования и операции, позволяя идентифицировать и значимую интерпретацию медицинских и физиологических исследований, необходимых для исследования космоса человеком, и определять эффективность конкретного человека. контрмеры по снижению риска и достижению целей в области здоровья и производительности в сложных исследовательских миссиях ».[137] Из-за трудностей в разработке такой математической модели, основанной на сложностях и переменных физиологии человека, работающего в необычной среде микрогравитации, полезность этого подхода, хотя и разумная, еще предстоит доказать.
Будущие исследовательские миссии
С самого начала необходимо указать, что риск (-ы), связанный с потерей массы, силы и выносливости скелетных мышц, зависит не только от уровня потери, но также от исходной точки и относительных физиологических затрат, необходимых для успешного выполнения необходимого задания. набор задач в фиксированный срок. Таким образом, член экипажа должен быть в состоянии выполнить задачу до того, как подвергнется воздействию микрогравитации, нельзя допустить, чтобы количество функциональных потерь упало ниже уровня, необходимого для успешного выполнения всех поставленных задач, а требования к физическим характеристикам для выполнения задач должны быть известен. Без информации, касающейся требований к физическим характеристикам задач, невозможно определить риск отказа.
Кроме того, если задачу не удалось выполнить члену экипажа до воздействия микрогравитации, можно разумно заявить, что риск отказа во время миссии составляет 100%. Однако, даже если член экипажа имеет возможность выполнить все возможные задачи, совокупность задач, которые должны быть выполнены в течение конечного периода, представляет собой совершенно другое требование, поскольку может быть возможно выбрать совокупность задач, которые должны быть выполнены в течение рабочего периода. это превышает возможности одного члена экипажа или, возможно, каждого члена экипажа. Кроме того, необходимо учитывать все возможные непредвиденные обстоятельства, которые могут возникнуть, чтобы член экипажа мог справиться с такими нестандартными сценариями даже ближе к концу рабочего дня. Таким образом, даже такой базовый подход, как продуманное планирование ежедневных задач, может помочь снизить риск.
Из приведенного выше обсуждения следует несколько важных моментов, которые необходимо знать в отношении рисков, связанных с потерей массы, силы и выносливости скелетных мышц. К ним относятся:
- Исходный уровень функциональной работоспособности члена экипажа (сила, выносливость, уровень функциональной работоспособности и т. Д.)
- Величина функциональной потери от исходного уровня в любой момент во время миссии
- Физиологическая потребность задачи или набора задач, которые необходимо выполнить
- Период времени, в который должны быть выполнены задачи
- Все возможные непредвиденные события, которые могут повлиять на функциональные характеристики
- Любые другие мешающие условия, которые могут повлиять на функциональные характеристики (например, состояние питания и психологический статус, характеристики костюма EVA, неисправность или отказ оборудования, болезнь, травма и т. Д.)
Указание на важность индивидуальных исходных показателей получено на иллюстративном примере из программы EDOMP. Потери в силе сгибателей и разгибателей туловища были больше у членов экипажа, которые тренировались на беговой дорожке Shuttle во время полета, чем у членов экипажа, которые не тренировались во время своей миссии (см. Рисунок 6-7). Хотя сначала это кажется нелогичным, объяснение дает простая логика. Члены экипажа, которые предпочли тренироваться во время полета, сделали это, потому что они регулярно тренировались как часть своего распорядка дня перед полетом. Поскольку они были на более высоком уровне физической подготовки, чем их группа членов экипажа, не выполняющих упражнения, они потеряли больше сил во время полета. Однако то, что нельзя установить из данных об% изменений, так это абсолютные уровни силы. Например, члены экипажа, которые потеряли в два раза больше силы мышц живота и спины, чем их не тренированные коллеги, могли бы иметь большую силу в этих мышцах, если бы они начали в три раза сильнее, чем их не тренировочные коллеги.
Миссии лунных вылетов
Что касается будущих миссий с участием людей, полеты на Луну, вероятно, будут представлять наименьший риск из запланированных в настоящее время миссий и, вероятно, не будут более опасными, чем миссии Аполлона (по крайней мере, в отношении работы скелетных мышц), если не запланированы необычные наземные операции. которые заметно отличаются от операций Аполлона на поверхности Луны. Максимальное суммарное время выхода экипажа на поверхность Луны во время программы «Аполлон» составило около 22 часов. (в сумме из 3-х отдельных дней), а наибольшая общая продолжительность пребывания экипажа на поверхности Луны составила около 75 часов во время шестой и последней миссии Аполлона (Аполлон-17).
Ответ на вопрос о том, должно ли оборудование для упражнений быть доступным для членов экипажа для коротких полетов на Луну и обратно, на самом деле прост, и ответ - твердое «да». Во время некоторых миссий «Аполлон» членам экипажа было предоставлено небольшое легкое устройство под названием «Exer-Genie», которое не требовало внешнего источника питания (см. Рис. 6-1), и им было предложено использовать его. Особо актуальны конкретные комментарии членов экипажа Аполлона, собранные во время недавнего «Саммита Аполлона». [138] и его можно резюмировать следующим образом:
- В коротких поездках нет необходимости в упражнениях, и экипажи не чувствовали, что они пострадали от заметного ухудшения условий, но они требовали, чтобы возможности для упражнений были доступны как можно больше для «отдыха и расслабления» на ВСЕХ этапах миссии. Тренажер использовался всеми членами экипажа с разной интенсивностью и интенсивностью. Лунные надводные команды (максимальное время, затраченное на наземные операции [выход в открытый космос] составляло 22 часа во время 75-часового пребывания Аполлона-17), чувствовали, что их действия на лунной поверхности обеспечивают достаточно упражнений для краткосрочной миссии, но были бы рады простому, прочное устройство для растяжки и тренировки предплечий. (Примечание: Exer-Genie остался в командном модуле с пилотом командного модуля; он не сопровождал двух астронавтов, которые спустились на поверхность Луны в лунном экскурсионном модуле.)
- Члены экипажа «Аполлона» считали, что хирурги и специалисты по планированию миссий не должны жестко планировать выполнение упражнений для таких краткосрочных миссий, а разрешать экипажу выполнять их в свободное время.
- Они заявили, что требуется более прочное и легкое оборудование для тренировок в полете, чем во время полета во время Аполлона. Exer-Genie был ограничен, его веревки были хрупкими, а устройство генерировало много тепла и запаха, поэтому требовалось альтернативное устройство для упражнений.
- Большинство членов экипажа считает, что сроки предварительной миссии должны обеспечить достаточное время для поддержания костно-мышечной силы и выносливости. Some astronauts attributed their capabilities on the lunar surface to pre-mission training because in some cases more force was needed on the lunar surface while wearing the EVA suit than was needed in 1G on Earth.
- The crew felt that Exer-Genie or an alternative was definitely needed, and because of a fear that they would break it, they actually tapered off from intense use to save it for use in reconditioning on the return trip before re-entry.
- The strongest comment was that "as many exercise capabilities as possible should be built into all future vehicles" because they will get used and the crew further felt that exercise capability throughout flight was critical and that a variety of exercises should be provided.
Миссии Лунного форпоста
Lunar outpost missions will present a greater challenge than shorter “sortie” missions, but with respect to the current risk topic they probably represent risks similar to those experienced on the ISS. Lunar gravity, although about 1/6 that of Earth gravity, is still more conducive to providing sufficient loading to maintain muscle mass and function than is microgravity. Certainly exercise regimens and hardware will be required, not only for countering muscle atrophy but for the reasons stated by Apollo astronauts above as well. How much exercise is needed and the proper way to implement it are certainly knowledge gaps that will require innovative research to fill. Part of this research will unquestionably help to define the level of risks to which crews will be exposed but will also be helpful in properly mitigating those risks.
Марс транзит
Without doubt, transport between the Earth and Mars as well as the return trip represent the greatest risks to humans encountered in the history of human spaceflight. Notwithstanding the risks of radiation exposure, deterioration of the musculoskeletal system must be prevented or a mission to Mars (and back) will not be successful. Highly refined exercise protocols and robust exercise equipment and methods to monitor functional capacity are mandatory for mitigation of the risks inherent in long-duration exposure of humans to microgravity. A huge challenge will be to provide the above within the current design of the crew exploration vehicle (CEV), which provides trivial space for equipment and crew. The cramped confines will afford little room for stretching or exercise. Modest or no power for equipment and a human life support system whose design may be marginal to support a full complement of exercise by efficiently dealing with the heat, water vapor, and carbon dioxide that are byproducts of human exercise are additional challenges that must be overcome.
Форпост Марса
Knowledge gained during lunar outpost missions will be highly relevant to successful establishment of a Martian outpost. If the challenges posed by the long transit to Mars and the extended period of microgravity exposure can be met, the outpost phase should represent a much lower risk by comparison, since lunar outpost experience will have allowed significant opportunity to develop risk-mitigation strategies for this phase. The gravitational environments are similar; in fact, the Martian gravity field, being greater than that of the Moon, will provide a less formidable setting. However, capability to provide sufficient exercise capacity during the Martian outpost phase is essential in preparing the crew for a long-duration exposure to microgravity on the transit back to Earth. This probably represents the greatest challenge with respect to maintaining a safe level of skeletal muscle performance for exploration-class missions.
Текущие пробелы
Despite four decades of effort, success in prevention of spaceflight muscle atrophy and skeletal muscle functional deficits has not yet been achieved in every case although progress has been made. Gaps in our knowledge have prevented us from implementing a countermeasures program that will fully mitigate the risks of losing muscle mass, function, and endurance during exposure to the microgravity of spaceflight, particularly during long-duration missions. There are also gaps in our knowledge about working and living in partial-G environments and the effect that wearing an EVA suit has on human performance in such an environment.
В микрогравитации
The major knowledge gaps that must be addressed by future research to mitigate this risk of loss of skeletal muscle mass, function, and endurance include the following:
- For humans living in a microgravity environment, the optimal exercise regimen, including the mode(s), intensity, and volume needed to minimize or fully mitigate risk, is not known. An appropriate exercise prescription must be developed and validated during spaceflight.
- The types and functional requirements of exercise hardware and the most comfortable human-to-hardware interfaces needed to minimize or fully mitigate risks is not known. Such hardware is likely to be mission-specific and should be validated in the appropriate environment.
- The effect on maintenance of skeletal muscle strength by in-flight use of the currently developed advanced Resistive Exercise Device (aRED) is not known. Because of the inherent shortcomings in the interim device (iRED) (maximum achievable load ~300 lbs), we have not provided an optimal resistance exercise opportunity for flight crews. An in-flight study utilizing aRED is essential in determining the efficacy of a program of combined aerobic and resistive exercise during long-duration microgravity exposure.
- The expected composite of mission-specific critical mission tasks and their physiologic costs to crewmembers during surface EVA operations is not well defined. This is essential to determining human functional requirements and attendant risk(s). The level of skeletal muscle loading and aerobic exercise provided by surface EVA on the Moon must be determined either through modeling or by lunar analog studies and then validated.
- For humans living in partial G environments, the optimal exercise regimens, including the mode(s), intensity, and volume needed to minimize risk, are not known. Appropriate exercise prescriptions must be developed and validated for partial G environments.
- EVA suits are known to reduce the effective maximum forces that can be generated by crewmembers for task completion so that a portion of the crewmember's work expenditure is lost in the resistance inherent to the suit. Suited human performance levels when working in partial G environments are not known and represent an additional knowledge gap that must be filled by conduct of appropriate research.
В аналоговой среде
- To develop the needed exercise regimens needed for different mission scenarios, analog environments will be necessary. The appropriate analog environments for optimizing mission-specific exercise prescriptions and exercise hardware are not yet well defined.
- Initially, a lunar analog environment will be necessary to determine if activities of daily life in combination with anticipated surface EVA activities will protect skeletal muscle function. The outcome of this study will determine what additional modes, intensities, and volumes of exercise will be needed to maintain skeletal muscle function in a lunar partial G environment.
- The results of lunar analog studies will be invaluable for the design and planning of a Martian outpost mission.
Сценарии работы геологоразведочной миссии
A mission to Mars or another planet or asteroid within the Solar System is not beyond possibility within the next two decades. Extended transit times to and from distant planetary bodies within the context of current CEV designs represents a formidable challenge to the life sciences community. Knowledge drawn from experience and research during long-duration microgravity exposure on the ISS will be beneficial in mitigating risks to humans during this phase. Many gaps in our current knowledge about living and working for long periods on planetary surfaces in partial G environments should be filled during lunar outpost missions.
Смотрите также
- Space Medicine - Loss of Muscle Mass
- Weightlessness - Human health effects
- Влияние космического полета на организм человека
- William E. Thornton - NASA Experience
- МКС
- Spacelab
- Скайлаб
- Мир
Акронимы и Аббревиатуры
| Акроним | Определение |
|---|---|
| 1-RM | Repetition maximum test |
| ACES | Advanced crew escape suits |
| ANOVA | Дисперсионный анализ |
| aRED | Advanced Resistive Exercise Device |
| ASCR | Astronaut Strength, Conditioning and Rehabilitation |
| CEV | Crew exploration vehicle |
| CEVIS | Cycle Ergometer with Vibration Isolation and Stabilization |
| СМ | Command module |
| CMP | Пилот командного модуля |
| CO2 | Углекислый газ |
| CSA | Cross-sectional area |
| DEXA | Dual energy x-ray absorptiometry |
| DoD | Министерство обороны |
| DSO | Detailed Science/Supplementary Objective |
| EDOMP | Extended Duration Orbiter Medical Project |
| ЭМГ | Электромиография |
| EVA | Внекорабельные развлечения |
| HR | Частота сердцебиения |
| HS | Hind limb suspension |
| iRED | Interim Resistive Exercise Device |
| МКС | Международная космическая станция |
| LBNP | Lower body negative pressure |
| LEM | Lunar excursion module |
| MHC | Myosin heavy chain |
| МРТ | Магнитно-резонансная томография |
| мРНК | Messenger Ribonucleic Acid |
| MURF | Muscle ring finger protein |
| НАСА | National Aeronautical Space Administration |
| О2 | Кислород |
| PRD | Program Requirements Document |
| КРАСНЫЙ | Resistive exercise device |
| SERCA II | Sarcoplasmic reticulum ATPase driven calcium pumps |
| SLS | Space Life Sciences |
| SMEAT | Skylab Medical Experiments Altitude Test |
| СОЛЬ | Soleus |
| SR | Саркоплазматический ретикулум |
| СТС | Shuttle Transport System |
| TVIS | Treadmill with Vibration Isolation and Stabilization |
| VI | Vastus intermedius |
| VO2-max | Maximal oxygen uptake; aerobic capacity |
Рекомендации
- ^ а б c Adams, GR; Caiozzo, VL; Baldwin, KM (1 December 2003). "Skeletal muscle unweighting: spaceflight and ground-based models". Журнал прикладной физиологии. 95 (6): 2185–2201. Дои:10.1152/japplphysiol.00346.2003. PMID 14600160. Архивировано из оригинал on 15 June 2013.
- ^ Caiozzo, VJ; Rose-Gottron, C; Болдуин, КМ; Cooper, D; Adams, G; Hicks, J; Kreitenberg, A (February 2004). "Hemodynamic and metabolic responses to hypergravity on a human-powered centrifuge". Авиация, космос и экологическая медицина. 75 (2): 101–8. PMID 14960043.
- ^ Link, MM (1965). "Space Medicine in Project Mercury". Washington, DC: NASA. Получено 14 мая 2013.
- ^ Johnston, RS (1975). "Introduction: Biomedical Results of Apollo". Вашингтон, округ Колумбия: НАСА. Архивировано из оригинал на 2013-05-16.
- ^ а б Rummel, JA; Sawin, C.F.; Michel, EL (1975). "Exercise Response". In Johnston, RS; Dietlein, LF; Berry, CA (eds.). Biomedical Results of Apollo. Вашингтон, округ Колумбия: НАСА. pp. 265–275.
- ^ MAXFIELD, ME; Brouha, L (November 1963). "Validity of Heart Rate as an Indicator of Cardiac Strain". Журнал прикладной физиологии. 18 (6): 1099–104. Дои:10.1152/jappl.1963.18.6.1099. PMID 14080727.
- ^ Kim, TS; Rahn, H; Farhi, LE (July 1966). "Estimation of true venous and arterial PCO2 by gas analysis of a single breath". Журнал прикладной физиологии. 21 (4): 1338–44. Дои:10.1152/jappl.1966.21.4.1338. PMID 5916672.
- ^ Buderer, MC; Rummel, JA; Sawin, CF; Mauldin, DG (July 1973). "Use of the single-breth method of estimating cardiac output during exercise-stress testing". Aerospce Medicine. 44 (7): 756–763.
- ^ а б c d е Dietlein, LF (1975). "Summary and conclusions". In Johnston, RS; Dietlein, LF; Berry, CA (eds.). Biomedical Results of Apollo. Вашингтон, округ Колумбия: НАСА.
- ^ а б c d е ж грамм час я j Thornton, WE; Rummel, JA (1977). "Muscular deconditioning and its prevention in spaceflight". In Johndton, RS; Dietlien, LF (eds.). Биомедицинские результаты от Skylab. Вашингтон, округ Колумбия: НАСА. С. 191–197.
- ^ а б Thornton, WE; Hoffler, GW; Rummel, JA (1977). "Anthropomorphic changes and fluid shifts". In Johnston, RS; Dietlein, LF (eds.). Biomedical Results of Skylab. Вашингтон, округ Колумбия: НАСА. pp. 330–338.
- ^ а б Whedon, GD; Lutwak, L; Rambaut, PC; Whittle, MW; Смит, MC; Reid, J; Leach, C; Stadler, CJ; Sanford, DD (1977). "Mineral and nitrogen netabolic studies - Experiment M071". In Johnston, RS; Dietlein, LF (eds.). Biomedical Results of Skylab. Вашингтон, округ Колумбия: НАСА. pp. 164–174.
- ^ а б c Stein, TP; Leskiw, MJ; Schluter, MD (July 1996). "Diet and nitrogen metabolism during spaceflight on the shuttle". Журнал прикладной физиологии. 81 (1): 82–97. Дои:10.1152/jappl.1996.81.1.82. PMID 8828650.
- ^ а б c d е ж грамм час я j k Greenisen, MC; Hayes, J; Siconolfi, S; Moore, A (1999). "Functional Performance Evaluation". In Sawin, CF; Taylor, GR; Smith, WL (eds.). Extended Duration Orbiter Medical Project Final Report 1989 - 1995. НАСА. pp. 3.1–3.24.
- ^ а б c Zhou, MY; Klitgaard, H; Saltin, B; Roy, RR; Эджертон, ВР; Gollnick, PD (May 1995). "Myosin heavy chain isoforms of human muscle after short-term spaceflight". Журнал прикладной физиологии. 78 (5): 1740–4. Дои:10.1152/jappl.1995.78.5.1740. PMID 7649907.
- ^ Itai, Y; Kariya, Y; Hoshino, Y (June 2004). "Morphological changes in rat hindlimb muscle fibres during recovery from disuse atrophy". Acta Physiologica Scandinavica. 181 (2): 217–24. Дои:10.1111/j.1365-201X.2004.01271.x. PMID 15180794.
- ^ Jaspers, SR; Tischler, ME (November 1984). "Atrophy and growth failure of rat hindlimb muscles in tail-cast suspension". Журнал прикладной физиологии: респираторная, экологическая и физическая физиология. 57 (5): 1472–9. Дои:10.1152/jappl.1984.57.5.1472. PMID 6520041.
- ^ Steffen, JM; Fell, RD; Geoghegan, TE; Ringel, LC; Musacchia, XJ (March 1990). "Age effects on rat hindlimb muscle atrophy during suspension unloading". Журнал прикладной физиологии. 68 (3): 927–31. Дои:10.1152/jappl.1990.68.3.927. PMID 1692824.
- ^ а б c d LeBlanc, A; Lin, C; Shackelford, L; Sinitsyn, V; Evans, H; Belichenko, O; Schenkman, B; Kozlovskaya, I; Oganov, V; Bakulin, A; Hedrick, T; Feeback, D (December 2000). "Muscle volume, MRI relaxation times (T2), and body composition after spaceflight". Журнал прикладной физиологии. 89 (6): 2158–64. Дои:10.1152/jappl.2000.89.6.2158. PMID 11090562. Архивировано из оригинал на 15.06.2013.
- ^ а б LeBlanc, A; Rowe, R; Schneider, V; Evans, H; Hedrick, T (December 1995). "Regional muscle loss after short duration spaceflight". Авиация, космос и экологическая медицина. 66 (12): 1151–4. PMID 8747608.
- ^ а б c d е ж LeBlanc, AD; Schneider, VS; Evans, HJ; Pientok, C; Rowe, R; Spector, E (November 1992). "Regional changes in muscle mass following 17 weeks of bed rest". Журнал прикладной физиологии. 73 (5): 2172–8. Дои:10.1152/jappl.1992.73.5.2172. PMID 1474100.
- ^ Schneider, SM; Amonette, WE; Blazine, K; Bentley, J; Lee, SM; Loehr, JA; Moore AD, Jr; Rapley, M; Mulder, ER; Smith, SM (November 2003). "Training with the International Space Station interim resistive exercise device" (PDF). Медицина и наука в спорте и физических упражнениях. 35 (11): 1935–45. Дои:10.1249 / 01.MSS.0000093611.88198.08. PMID 14600562. Архивировано из оригинал (PDF) на 2013-10-12.
- ^ Lee, SM; Cobb, K; Loehr, JA; Nguyen, D; Schneider, SM (May 2004). "Foot-ground reaction force during resistive exercise in parabolic flight". Авиация, космос и экологическая медицина. 75 (5): 405–12. PMID 15152892.
- ^ а б Lee, SM; Shakelford, LC; Смит, С.М.; Guilliams, ME; Loehr, JA; Шеперд, B; Laughlin, MS; Chauvin, J; Hagan, RD (2004). "Lean tissue mass and muscle strength: Does resistive exercise prevent space flight deconditioning?". Медико-спортивные упражнения. 36 (5): S272. Дои:10.1249/00005768-200405001-01304.
- ^ Hayes, JC; McBrine, JJ; Roper, ML; и другие. (1992). "Effects of space flight on skeletal muscle performance". FASEB J. 6: A1770.
- ^ Tesch, PA; Berg, HE; Bring, D; Evans, HJ; LeBlanc, AD (January 2005). "Effects of 17-day spaceflight on knee extensor muscle function and size". European Journal of Applied Physiology. 93 (4): 463–8. Дои:10.1007/s00421-004-1236-9. PMID 15517339. S2CID 22935915.
- ^ Kakurin, LI; Cherepakhin, MA; Ushakov, AS; Senkevich, YA (1971). "Functional insufficiency of the neuromuscular system caused by weightlessness and hypokinesia". Науки о жизни и космические исследования. 10: 61–4. PMID 11898843.
- ^ LeBlanc, A; Schneider, V; Shackelford, L; West, S; Oganov, V; Bakulin, A; Voronin, L (December 2000). "Bone mineral and lean tissue loss after long duration space flight" (PDF). Журнал скелетно-мышечных и нейронных взаимодействий. 1 (2): 157–60. PMID 15758512.
- ^ а б Grigoriev, AI; Bugrov, SA; Bogomolov, VV; Egorov, AD; Kozlovskaya, IB; Pestov, ID; Polyakov, VV; Tarasov, IK (February 1991). "Medical results of the Mir year-long mission". The Physiologist. 34 (1 Suppl): S44–8. Bibcode:1991AcAau..23....1G. Дои:10.1016/0094-5765(91)90092-J. PMID 2047465.
- ^ а б Kozlovskaya, IB; Aslanova, IF; Barmin, VA; и другие. (1983). "The naure and characteristics of gravitational ataxia". Физиолог. 501 (Pt. 1): 287–295.
- ^ Kozlovskaya, IB; Barmin, VA; Stepantsov, VI; Kharitonov, NM (February 1990). "Results of studies of motor functions in long-term space flights". The Physiologist. 33 (1 Suppl): S1–3. PMID 2371310.
- ^ а б Vorobyov, EI; Gazenko, OG; Genin, AM; Egorov, AD (December 1983). "Medical results of Salyut-6 manned space flights". Авиация, космос и экологическая медицина. 54 (12 Pt 2): S31–40. PMID 6661132.
- ^ Akima, H; Kawakami, Y; Кубо, К; Sekiguchi, C; Ohshima, H; Miyamoto, A; Fukunaga, T (October 2000). "Effect of short-duration spaceflight on thigh and leg muscle volume" (PDF). Медицина и наука в спорте и физических упражнениях. 32 (10): 1743–7. Дои:10.1097/00005768-200010000-00013. PMID 11039647. Архивировано из оригинал (PDF) на 2014-05-04.
- ^ Day, MK; Allen, DL; Mohajerani, L; Greenisen, MC; Roy, RR; Edgerton, VR (1995). "Adaptations of human skeletal muscle fibers to spaceflight". Journal of Gravitational Physiology : A Journal of the International Society for Gravitational Physiology. 2 (1): P47–50. PMID 11538928.
- ^ Эджертон, ВР; Zhou, MY; Ohira, Y; Klitgaard, H; Цзян, Б; Bell, G; Harris, B; Saltin, B; Gollnick, PD; Roy, RR (May 1995). "Human fiber size and enzymatic properties after 5 and 11 days of spaceflight". Журнал прикладной физиологии. 78 (5): 1733–9. Дои:10.1152/jappl.1995.78.5.1733. PMID 7649906.
- ^ Shenkman, B; Kozlovska, IB; Siconolfi, SF (1997). "Structure and function of knee extensors after long-duration spaceflight in man: effects of countermeasure exercise training". 12th Man in Space Symposium. Вашингтон, округ Колумбия.
- ^ Fitts, R.H .; Widrick, J. J.; Knuth, S. T.; Blaser, C. A.; Karhanek, M.; Trappe, S.W .; Trappe, T. A.; Costill, D. L. (1997). "Force-velocity and force-power properties of human muscle fibers after spaceflight". Медико-спортивные упражнения. 29: S1081. Дои:10.1097/00005768-199705001-01080.
- ^ Trappe, SW; Trappe, TA; Lee, GA; и другие. (1997). "Effect of spaceflight on human calf muscle morphology and function (abstract)". Медико-спортивные упражнения. 29: S1085. Дои:10.1097/00005768-199705001-01084.
- ^ а б Trappe, SW; Trappe, TA; Lee, GA; Widrick, JJ; Costill, DL; Fitts, RH (July 2001). "Comparison of a space shuttle flight (STS-78) and bed rest on human muscle function". Журнал прикладной физиологии. 91 (1): 57–64. Дои:10.1152/jappl.2001.91.1.57. PMID 11408413. Архивировано из оригинал на 15.06.2013.
- ^ Эджертон, ВР; Roy, RR (1994). Neuromuscular adaptation to actual and simulated weightlessness. Advances in Space Biology and Medicine. 4. pp. 33–67. Дои:10.1002/cphy.cp040132. ISBN 9780470650714. PMID 7757253.
- ^ Kozlovskaia, IB; Grigor'eva, LS; Gevlich, GI (November–December 1984). "[Comparative analysis of the effect of weightlessness and its model on the velocity-strength properties and tonus of human skeletal muscles]". Kosmicheskaia Biologiia I Aviakosmicheskaia Meditsina. 18 (6): 22–6. PMID 6513481.
- ^ Layne, CS; Spooner, BS (1994). "Microgravity effects on "postural" muscle activity patterns". Достижения в космических исследованиях. 14 (8): 381–4. Bibcode:1994AdSpR..14..381L. Дои:10.1016/0273-1177(94)90427-8. PMID 11537944.
- ^ Layne, CS; McDonald, PV; Bloomberg, JJ (January 1997). "Neuromuscular activation patterns during treadmill walking after space flight" (PDF). Экспериментальное исследование мозга. Experimentelle Hirnforschung. Эксперименты Cerebrale. 113 (1): 104–16. Дои:10.1007/bf02454146. PMID 9028779. S2CID 18514959.
- ^ Antonutto, G; Capelli, C; Girardis, M; Zamparo, P; di Prampero, PE (January 1999). "Effects of microgravity on maximal power of lower limbs during very short efforts in humans". Журнал прикладной физиологии. 86 (1): 85–92. Дои:10.1152/jappl.1999.86.1.85. PMID 9887117. Архивировано из оригинал на 15.06.2013.
- ^ Antonutto, G; Capelli, C; Giradis, M; Zamparo, P; di Prampero, PE (October–December 1995). "Effects of microgravity on muscular explosive power of the lower limbs in humans". Acta Astronautica. 36 (8–12): 473–8. Bibcode:1995AcAau..36..473A. Дои:10.1016/0094-5765(95)00133-6. PMID 11540979.
- ^ а б c d Bamman, MM; Clarke, MS; Feeback, DL; Talmadge, RJ; Stevens, BR; Lieberman, SA; Greenisen, MC (January 1998). "Impact of resistance exercise during bed rest on skeletal muscle sarcopenia and myosin isoform distribution". Журнал прикладной физиологии. 84 (1): 157–63. Дои:10.1152/jappl.1998.84.1.157. PMID 9451630. Архивировано из оригинал на 15.06.2013.
- ^ а б Bamman, MM; Hunter, GR; Stevens, BR; Guilliams, ME; Greenisen, MC (November 1997). "Resistance exercise prevents plantar flexor deconditioning during bed rest". Медицина и наука в спорте и физических упражнениях. 29 (11): 1462–8. Дои:10.1097/00005768-199711000-00012. PMID 9372483.
- ^ а б Ferrando, AA; Tipton, KD; Bamman, MM; Wolfe, RR (March 1997). "Resistance exercise maintains skeletal muscle protein synthesis during bed rest". Журнал прикладной физиологии. 82 (3): 807–10. Дои:10.1152/jappl.1997.82.3.807. PMID 9074967. Архивировано из оригинал на 16.06.2013.
- ^ а б c Akima, H; Кубо, К; Kanehisa, H; Сузуки, Y; Gunji, A; Fukunaga, T (May 2000). "Leg-press resistance training during 20 days of 6 degrees head-down-tilt bed rest prevents muscle deconditioning". Eur J Appl Physiol. 82 (1–2): 30–38. Дои:10.1007/s004210050648. PMID 10879440. S2CID 23150166.
- ^ а б c d е Shackelford, LC; LeBlanc, AD; Driscoll, TB; Evans, HJ; Rianon, NJ; Смит, С.М.; Spector, E; Feeback, DL; Lai, D (July 2004). "Resistance exercise as a countermeasure to disuse-induced bone loss". Журнал прикладной физиологии. 97 (1): 119–29. Дои:10.1152/japplphysiol.00741.2003. PMID 15220316. Архивировано из оригинал на 15.06.2013.
- ^ Alkner, BA; Tesch, PA (December 2004). "Knee extensor and plantar flexor muscle size and function following 90 days of bed rest with or without resistance exercise". European Journal of Applied Physiology. 93 (3): 294–305. Дои:10.1007/s00421-004-1172-8. PMID 15338217. S2CID 20556976.
- ^ а б Ferrando, AA; Lane, HW; Стюарт, Калифорния; Davis-Street, J; Wolfe, RR (April 1996). "Prolonged bed rest decreases skeletal muscle and whole body protein synthesis". Американский журнал физиологии. 270 (4 Pt 1): E627–33. Дои:10.1152/ajpendo.1996.270.4.E627. PMID 8928769.
- ^ Стюарт, Калифорния; Shangraw, RE; Peters, EJ; Wolfe, RR (September 1990). "Effect of dietary protein on bed-rest-related changes in whole-body-protein synthesis". Американский журнал клинического питания. 52 (3): 509–14. Дои:10.1093/ajcn/52.3.509. PMID 2203254.
- ^ Ferrando, AA; Стюарт, Калифорния; Brunder, DG; Hillman, GR (October 1995). "Magnetic resonance imaging quantitation of changes in muscle volume during 7 days of strict bed rest". Авиация, космос и экологическая медицина. 66 (10): 976–81. PMID 8526835.
- ^ LeBlanc, A; Gogia, P; Schneider, V; Krebs, J; Schonfeld, E; Evans, H (November–December 1988). "Calf muscle area and strength changes after five weeks of horizontal bed rest". Американский журнал спортивной медицины. 16 (6): 624–9. Дои:10.1177/036354658801600612. PMID 3239619. S2CID 11865820.
- ^ Dudley, GA; Duvoisin, MR; Конвертино, Вирджиния; Buchanan, P (July 1989). "Alterations of the in vivo torque-velocity relationship of human skeletal muscle following 30 days exposure to simulated microgravity". Авиация, космос и экологическая медицина. 60 (7): 659–63. PMID 2764849.
- ^ а б c Dudley, GA; Duvoisin, MR; Adams, GR; Meyer, RA; Belew, AH; Buchanan, P (August 1992). "Adaptations to unilateral lower limb suspension in humans". Авиация, космос и экологическая медицина. 63 (8): 678–83. PMID 1510640.
- ^ Katkovskiy, BS; Machinskiy, GV; Toman, PS; Danilova, VI; Demida, BF (1974). "Man's physical performance after 30-day hypokinesia with countermeasures". Kosm Biol Aviakosm Med. 8 (3): 43–47. PMID 4857606.
- ^ Berg, HE; Dudley, GA; Häggmark, T; Ohlsén, H; Tesch, PA (April 1991). "Effects of lower limb unloading on skeletal muscle mass and function in humans". Журнал прикладной физиологии. 70 (4): 1882–5. Дои:10.1152/jappl.1991.70.4.1882. PMID 2055867.
- ^ а б Hather, BM; Adams, GR; Tesch, PA; Dudley, GA (April 1992). "Skeletal muscle responses to lower limb suspension in humans". Журнал прикладной физиологии. 72 (4): 1493–8. Дои:10.1152/jappl.1992.72.4.1493. PMID 1534323.
- ^ Grigor'eva, LS; Kozlovskaia, IB (July–August 1985). "[Effect of 7-day immersion hypokinesia on the characteristics of precise movements]". Kosmicheskaia Biologiia I Aviakosmicheskaia Meditsina. 19 (4): 38–42. PMID 4057930.
- ^ Koryak, Y (December 2002). ""DRY" immersion induces neural and contractile adaptations in the human triceps surae muscle" (PDF). Environmental Medicine : Annual Report of the Research Institute of Environmental Medicine, Nagoya University. 46 (1–2): 17–27. PMID 12666668.
- ^ Kozlovskaya, IB; Aslanova, IF; Grigorieva, LS; Kreidich, YuV (December 1982). "Experimental analysis of motor effects of weightlessness". The Physiologist. 25 (6): S49–52. PMID 7186145.
- ^ Miller, TF; Saenko, IV; Popov, DV; Vinogradova, OL; Kozlovskaya, IB (July 2004). "Effect of mechanical stimulation of the support zones of soles on the muscle stiffness in 7-day dry immersion". Journal of Gravitational Physiology : A Journal of the International Society for Gravitational Physiology. 11 (2): P135–6. PMID 16237815.
- ^ Netreba, AI; Khusnutdinova, DR; Vinogradova, OL; Kozlovskaya, IB (July 2004). "Effect of dry immersion in combination with stimulation of foot support zones upon muscle force-velocity characteristics". Journal of Gravitational Physiology : A Journal of the International Society for Gravitational Physiology. 11 (2): P129–30. PMID 16237812.
- ^ Shenkman, BS; Litvinova, KS; Nemirovskaya, TL; Podlubnaya, ZA; Vikhlyantsev, IM; Kozlovskaya, IB (July 2004). "Afferent and peripheral control of muscle fiber properties during gravitational unloading". Journal of Gravitational Physiology : A Journal of the International Society for Gravitational Physiology. 11 (2): P111–4. PMID 16235439.
- ^ а б Berg, Hans (1996). Effects of unloading on skeletal muscle mass and function in man. Stockholm: Karolinska Institute. ISBN 978-91-628-1962-0.
- ^ Hikida, RS; Gollnick, PD; Dudley, GA; Конвертино, Вирджиния; Buchanan, P (July 1989). "Structural and metabolic characteristics of human skeletal muscle following 30 days of simulated microgravity". Авиация, космос и экологическая медицина. 60 (7): 664–70. PMID 2764850.
- ^ Il'ina-Kakuyeva, YI; Portugalov, VV; Krivenkov, NP; и другие. (1979). "effects of physical conditioning and electric stimulation on metabolic processes in the soleus muscle and structure thereof in hypokinetic man". Kosm Biol Aviakosm. 13: 35–38.
- ^ Bamman, MM; Clarke, MS; Talmadge, RJ; Feeback, DL (March 1999). "Enhanced protein electrophoresis technique for separating human skeletal muscle myosin heavy chain isoforms". Электрофорез. 20 (3): 466–8. Дои:10.1002/(SICI)1522-2683(19990301)20:3<466::AID-ELPS466>3.0.CO;2-7. PMID 10217154.
- ^ Gallagher, P; Trappe, S; Harber, M; Creer, A; Mazzetti, S; Trappe, T; Alkner, B; Tesch, P (September 2005). "Effects of 84-days of bedrest and resistance training on single muscle fibre myosin heavy chain distribution in human vastus lateralis and soleus muscles". Acta Physiologica Scandinavica. 185 (1): 61–9. Дои:10.1111/j.1365-201X.2005.01457.x. PMID 16128698.
- ^ Virtanen, P; Väänänen, HK; Pasanen, L; Lähde, S; Puranen, J; Takala, TE (July 1991). "Effect of immobilization on carbonic anhydrase III and myoglobin content in human leg muscle". Acta Physiologica Scandinavica. 142 (3): 303–6. Дои:10.1111/j.1748-1716.1991.tb09161.x. PMID 1927544.
- ^ Ward, GR; MacDougall, JD; Sutton, JR; Toews, CJ; Jones, NL (February 1986). "Activation of human muscle pyruvate dehydrogenase with activity and immobilization". Клиническая наука. 70 (2): 207–10. Дои:10.1042/cs0700207. PMID 3956111.
- ^ Berg, HE; Dudley, GA; Hather, B; Tesch, PA (July 1993). "Work capacity and metabolic and morphologic characteristics of the human quadriceps muscle in response to unloading". Клиническая физиология. 13 (4): 337–47. Дои:10.1111/j.1475-097X.1993.tb00334.x. PMID 8370234.
- ^ Buckey, Jay C. (2006). "Muscle Loss: A Practical Guide to Maintaining Strength". Космическая физиология ([Online-Ausg.]. Ред.). Oxford: Oxford university press. pp. 78–100. ISBN 978-0-19-513725-5.
- ^ Koryak, Y (1995). "Contractile properties of the human triceps surae muscle during simulated weightlessness". Европейский журнал прикладной физиологии и физиологии труда. 70 (4): 344–50. Дои:10.1007/BF00865032. PMID 7649146. S2CID 6663407.
- ^ Grana, EA; Chiou-Tan, F; Jaweed, MM (August 1996). "Endplate dysfunction in healthy muscle following a period of disuse". Мышцы и нервы. 19 (8): 989–93. Дои:10.1002/(SICI)1097-4598(199608)19:8<989::AID-MUS6>3.0.CO;2-4. PMID 8756164.
- ^ Rittweger, J; Frost, HM; Schiessl, H; Ohshima, H; Alkner, B; Tesch, P; Felsenberg, D (June 2005). "Muscle atrophy and bone loss after 90 days' bed rest and the effects of flywheel resistive exercise and pamidronate: results from the LTBR study". Кость. 36 (6): 1019–29. Дои:10.1016/j.bone.2004.11.014. PMID 15811637.
- ^ Berg, HE; Eiken, O; Miklavcic, L; Mekjavic, IB (February 2007). "Hip, thigh and calf muscle atrophy and bone loss after 5-week bedrest inactivity". European Journal of Applied Physiology. 99 (3): 283–9. Дои:10.1007/s00421-006-0346-y. PMID 17186305. S2CID 40929101.
- ^ Popova, IA; Afonin, BV; Davydova, NA; Grigoriev, AI (February 1987). "Hormonal regulation in space flights of varying duration". The Physiologist. 30 (1 Suppl): S42–4. PMID 3562618.
- ^ Grigoriev, AI; Popova, IA; Ushakov, AS (September 1987). "Metabolic and hormonal status of crewmembers in short-term spaceflights". Авиация, космос и экологическая медицина. 58 (9 Pt 2): A121–5. PMID 3675477.
- ^ Leach, CS (1992). "Biochemical and hematologic changes after short-term space flight". Microgravity Quarterly : MGQ. 2 (2): 69–75. PMID 11537105.
- ^ Smirnov, KV; Rubinova, LG; Afonin, BV; Noskov, VB; Kravchenko, VV (May–June 1991). "[Functional carbohydrate test during 237-day space flight]". Kosmicheskaia Biologiia I Aviakosmicheskaia Meditsina. 25 (3): 61–2. PMID 1770772.
- ^ Dolkas, CB; Greenleaf, JE (December 1977). "Insulin and glucose responses during bed rest with isotonic and isometric exercise". Журнал прикладной физиологии: респираторная, экологическая и физическая физиология. 43 (6): 1033–8. Дои:10.1152/jappl.1977.43.6.1033. PMID 606688.
- ^ Lipman, RL; Raskin, P; Love, T; Triebwasser, J; Lecocq, FR; Schnure, JJ (February 1972). "Glucose intolerance during decreased physical activity in man" (PDF). Сахарный диабет. 21 (2): 101–7. Дои:10.2337/diab.21.2.101. PMID 4621842. S2CID 12659412.
- ^ Maaß, H; Raabe, W.; Wegmann, H. M. (1995). "Effects of Microgravity on Glucose Tolerance". In Sahm, PR; Keller, MH; Schiewe, R (eds.). Proceedings of the Norderney Symposium on Scientific Results of the German Spacelab Mission D2. Anthrorack on the Spacelab D2 Mission. 1191. Colonge: Wissenschaftliche Projektfuhrung. п. 732. Bibcode:1997ESASP1191...85M. ISBN 978-3-89100-025-0.
- ^ Fortney, SM (1991). "Exercise thermoregulation: possible effects of spaceflight". SAE Tech Paper Series. SAE Technical Paper Series. 911460: 1. Дои:10.4271/911460.
- ^ а б Pisacane, VL; Kuznetz, LH; Logan, JS; Clark, JB; Wissler, EH (April 2007). "Thermoregulatory models of space shuttle and space station activities". Авиация, космос и экологическая медицина. 78 (4 Suppl): A48–55. PMID 17511299.
- ^ а б c Fortney, SM; Mikhaylov, V; Lee, SM; Kobzev, Y; Гонсалес, Р.Р .; Greenleaf, JE (February 1998). "Body temperature and thermoregulation during submaximal exercise after 115-day spaceflight". Авиация, космос и экологическая медицина. 69 (2): 137–41. PMID 9491252.
- ^ а б Greenleaf, JE (August 1989). "Energy and thermal regulation during bed rest and spaceflight". Журнал прикладной физиологии. 67 (2): 507–16. Дои:10.1152/jappl.1989.67.2.507. PMID 2676944.
- ^ Lee, SM; Williams, WJ; Schneider, SM (May 2002). "Role of skin blood flow and sweating rate in exercise thermoregulation after bed rest". Журнал прикладной физиологии. 92 (5): 2026–34. Дои:10.1152/japplphysiol.00105.2001. PMID 11960954.
- ^ Greenleaf, JE; Reese, RD (January 1980). "Exercise thermoregulation after 14 days of bed rest". Журнал прикладной физиологии: респираторная, экологическая и физическая физиология. 48 (1): 72–8. Дои:10.1152/jappl.1980.48.1.72. PMID 7353981.
- ^ а б c Thomason, DB; Herrick, RE; Surdyka, D; Baldwin, KM (July 1987). "Time course of soleus muscle myosin expression during hindlimb suspension and recovery". Журнал прикладной физиологии. 63 (1): 130–7. Дои:10.1152/jappl.1987.63.1.130. PMID 2957349.
- ^ а б c d е ж грамм Riley, DA; Эллис, S; Slocum, GR; Sedlak, FR; Bain, JL; Krippendorf, BB; Lehman, CT; Macias, MY; Thompson, JL; Vijayan, K; De Bruin, JA (July 1996). "In-flight and postflight changes in skeletal muscles of SLS-1 and SLS-2 spaceflown rats". Журнал прикладной физиологии. 81 (1): 133–44. Дои:10.1152/jappl.1996.81.1.133. PMID 8828655.
- ^ Alford, Elward K.; Roy, Roland R.; Ходжсон, Джон А .; Edgerton, V.R. (1987). "Electromyography of rat soleus, medical gastrocnemius, and tibialis anterior during hind limb suspension". Экспериментальная неврология. 96 (3): 635–649. Дои:10.1016/0014-4886(87)90225-1. PMID 3582549. S2CID 177671.
- ^ а б c d е ж грамм час Roy, RR; Болдуин, КМ; Edgerton, VR (1996). "Response of the neuromuscular unit to spaceflight: what has been learned from the rat model". Обзоры упражнений и спортивных наук. 24: 399–425. Дои:10.1249/00003677-199600240-00015. PMID 8744257. S2CID 44574997.
- ^ а б Baldwin, KM (October 1996). "Effects of altered loading states on muscle plasticity: what have we learned from rodents?". Медицина и наука в спорте и физических упражнениях. 28 (10 Suppl): S101–6. Дои:10.1097/00005768-199610000-00042. PMID 8897413.
- ^ а б Baldwin, KM (August 1996). "Effect of spaceflight on the functional, biochemical, and metabolic properties of skeletal muscle". Медицина и наука в спорте и физических упражнениях. 28 (8): 983–7. Дои:10.1097/00005768-199608000-00008. PMID 8871908.
- ^ Эджертон, ВР; Roy, RR (1995). "Neuromuscular Adaptation to actual and simulated spaceflight". In Fregly, MJ; Blatteis, CM (ред.). Handbook of Physiology: Environmental Physiology. Нью-Йорк: Издательство Оксфордского университета. pp. 721–763.
- ^ а б Musacchia, XJ; Steffen, JM; Fell, RD (1988). "Disuse atrophy of skeletal muscle: animal models". Обзоры упражнений и спортивных наук. 16: 61–87. Дои:10.1249/00003677-198800160-00005. PMID 3292267. S2CID 41839363.
- ^ а б Thomason, DB; Booth, FW (January 1990). "Atrophy of the soleus muscle by hindlimb unweighting". Журнал прикладной физиологии. 68 (1): 1–12. Дои:10.1152/jappl.1990.68.1.1. PMID 2179205.
- ^ а б c Болдуин, КМ; Herrick, RE; McCue, SA (December 1993). "Substrate oxidation capacity in rodent skeletal muscle: effects of exposure to zero gravity". Журнал прикладной физиологии. 75 (6): 2466–70. Дои:10.1152/jappl.1993.75.6.2466. PMID 8125864.
- ^ а б c d Болдуин, КМ; Herrick, RE; Ilyina-Kakueva, E; Oganov, VS (January 1990). "Effects of zero gravity on myofibril content and isomyosin distribution in rodent skeletal muscle". Журнал FASEB. 4 (1): 79–83. Дои:10.1096/fasebj.4.1.2136840. PMID 2136840. S2CID 34715372.
- ^ а б c Caiozzo, VJ; Baker, MJ; Herrick, RE; Tao, M; Baldwin, KM (April 1994). "Effect of spaceflight on skeletal muscle: mechanical properties and myosin isoform content of a slow muscle". Журнал прикладной физиологии. 76 (4): 1764–73. Дои:10.1152/jappl.1994.76.4.1764. PMID 8045858.
- ^ а б c d е ж грамм Caiozzo, VJ; Хаддад, Ф; Baker, MJ; Herrick, RE; Prietto, N; Baldwin, KM (July 1996). "Microgravity-induced transformations of myosin isoforms and contractile properties of skeletal muscle". Журнал прикладной физиологии. 81 (1): 123–32. Дои:10.1152/jappl.1996.81.1.123. PMID 8828654.
- ^ Ilyina-Kakueva, EI; Portugalov, VV; Krivenkova, NP (July 1976). "Space flight effects on the skeletal muscles of rats". Авиация, космос и экологическая медицина. 47 (7): 700–3. PMID 184776.
- ^ Цзян, Б; Ohira, Y; Roy, RR; Nguyen, Q; Ilyina-Kakueva, EI; Oganov, V; Edgerton, VR (August 1992). "Adaptation of fibers in fast-twitch muscles of rats to spaceflight and hindlimb suspension". Журнал прикладной физиологии. 73 (2 Suppl): 58S–65S. Дои:10.1152/jappl.1992.73.2.S58. PMID 1388149.
- ^ Martin, TP; Эджертон, ВР; Grindeland, RE (November 1988). "Influence of spaceflight on rat skeletal muscle". Журнал прикладной физиологии. 65 (5): 2318–25. Дои:10.1152/jappl.1988.65.5.2318. PMID 2974847.
- ^ McDonald, KS; Delp, MD; Fitts, RH (June 1992). "Effect of hindlimb unweighting on tissue blood flow in the rat". Журнал прикладной физиологии. 72 (6): 2210–8. Дои:10.1152/jappl.1992.72.6.2210. HDL:2060/19980214880. PMID 1629075.
- ^ Musacchia, XJ; Steffen, JM; Fell, RD; Dombrowski, MJ (December 1990). "Skeletal muscle response to spaceflight, whole body suspension, and recovery in rats". Журнал прикладной физиологии. 69 (6): 2248–53. Дои:10.1152/jappl.1990.69.6.2248. PMID 2077023.
- ^ а б c Musacchia, XJ; Steffen, JM; Fell, RD; Dombrowski, MJ; Oganov, VW; Ilyina-Kakueva, EI (August 1992). "Skeletal muscle atrophy in response to 14 days of weightlessness: vastus medialis". Журнал прикладной физиологии. 73 (2 Suppl): 44S–50S. Дои:10.1152/jappl.1992.73.2.S44. PMID 1382051.
- ^ а б c d Ohira, Y; Цзян, Б; Roy, RR; Oganov, V; Ilyina-Kakueva, E; Marini, JF; Edgerton, VR (August 1992). "Rat soleus muscle fiber responses to 14 days of spaceflight and hindlimb suspension". Журнал прикладной физиологии. 73 (2 Suppl): 51S–57S. Дои:10.1152/jappl.1992.73.2.S51. PMID 1388148.
- ^ а б c d Riley, DA; Thompson, JL; Krippendorf, BB; Slocum, GR (1995). "Review of spaceflight and hindlimb suspension unloading induced sarcomere damage and repair" (PDF). Basic and Applied Myology. 5 (2): 139–45. PMID 11539271.
- ^ Roy, RR; Болдуин, КМ; Edgerton, VR (1991). "The plasticity of skeletal muscle: effects of neuromuscular activity". Обзоры упражнений и спортивных наук. 19: 269–312. Дои:10.1249/00003677-199101000-00008. PMID 1936088.
- ^ Giger, JM; Хаддад, Ф; Qin, AX; Zeng, M; Baldwin, KM (April 2005). "Effect of unloading on type I myosin heavy chain gene regulation in rat soleus muscle". Журнал прикладной физиологии. 98 (4): 1185–94. Дои:10.1152/japplphysiol.01099.2004. PMID 15591287. S2CID 16689958.
- ^ а б c d Хаддад, Ф; Herrick, RE; Adams, GR; Baldwin, KM (December 1993). "Myosin heavy chain expression in rodent skeletal muscle: effects of exposure to zero gravity". Журнал прикладной физиологии. 75 (6): 2471–7. Дои:10.1152/jappl.1993.75.6.2471. PMID 7510278.
- ^ а б Gardetto, PR; Schluter, JM; Fitts, RH (June 1989). "Contractile function of single muscle fibers after hindlimb suspension". Журнал прикладной физиологии. 66 (6): 2739–49. Дои:10.1152/jappl.1989.66.6.2739. PMID 2745338.
- ^ а б Diffee, GM; Caiozzo, VJ; Herrick, RE; Baldwin, KM (March 1991). "Contractile and biochemical properties of rat soleus and plantaris after hindlimb suspension". Американский журнал физиологии. 260 (3 Pt 1): C528–34. Дои:10.1152/ajpcell.1991.260.3.C528. PMID 1825904.
- ^ а б Diffee, GM; Caiozzo, VJ; McCue, SA; Herrick, RE; Baldwin, KM (May 1993). "Activity-induced regulation of myosin isoform distribution: comparison of two contractile activity programs". Журнал прикладной физиологии. 74 (5): 2509–16. Дои:10.1152/jappl.1993.74.5.2509. PMID 8335584.
- ^ а б Winiarski, AM; Roy, RR; Alford, EK; Chiang, PC; Edgerton, VR (June 1987). "Mechanical properties of rat skeletal muscle after hind limb suspension". Экспериментальная неврология. 96 (3): 650–60. Дои:10.1016/0014-4886(87)90226-3. PMID 3582550. S2CID 12290146.
- ^ а б c Pandorf, CE; Хаддад, Ф; Roy, RR; Qin, AX; Эджертон, ВР; Baldwin, KM (15 December 2006). "Dynamics of myosin heavy chain gene regulation in slow skeletal muscle: role of natural antisense RNA" (PDF). Журнал биологической химии. 281 (50): 38330–42. Дои:10.1074/jbc.M607249200. PMID 17030512. S2CID 28946494.
- ^ а б Thomason, DB; Morrison, PR; Oganov, V; Ilyina-Kakueva, E; Booth, FW; Baldwin, KM (August 1992). "Altered actin and myosin expression in muscle during exposure to microgravity". Журнал прикладной физиологии. 73 (2 Suppl): 90S–93S. Дои:10.1152/jappl.1992.73.2.S90. PMID 1326514. Архивировано из оригинал на 15.06.2013.
- ^ Chi, MM; Choksi, R; Nemeth, P; Krasnov, I; Ilyina-Kakueva, E; Manchester, JK; Lowry, OH (August 1992). "Effects of microgravity and tail suspension on enzymes of individual soleus and tibialis anterior fibers". Журнал прикладной физиологии. 73 (2 Suppl): 66S–73S. Дои:10.1152/jappl.1992.73.2.S66. PMID 1388150.
- ^ Стивенс, L; Mounier, Y; Holy, X (April 1993). "Functional adaptation of different rat skeletal muscles to weightlessness". Американский журнал физиологии. 264 (4 Pt 2): R770–6. Дои:10.1152/ajpregu.1993.264.4.R770. PMID 8476119.
- ^ McDonald, KS; Delp, MD; Fitts, RH (September 1992). "Fatigability and blood flow in the rat gastrocnemius-plantaris-soleus after hindlimb suspension". Журнал прикладной физиологии. 73 (3): 1135–40. Дои:10.1152/jappl.1992.73.3.1135. HDL:2060/19980007728. PMID 1400027.
- ^ Fitts, RH; Metzger, JM; Riley, DA; Unsworth, BR (June 1986). "Models of disuse: a comparison of hindlimb suspension and immobilization". Журнал прикладной физиологии. 60 (6): 1946–53. Дои:10.1152/jappl.1986.60.6.1946. PMID 3722061.
- ^ а б Krippendorf, BB; Riley, DA (June 1993). "Distinguishing unloading- versus reloading-induced changes in rat soleus muscle". Мышцы и нервы. 16 (1): 99–108. Дои:10.1002/mus.880160116. PMID 8423838. S2CID 23012375.
- ^ а б c Adams, GR; Хаддад, Ф; Bodell, PW; Tran, PD; Baldwin, KM (November 2007). "Combined isometric, concentric, and eccentric resistance exercise prevents unloading-induced muscle atrophy in rats". Журнал прикладной физиологии. 103 (5): 1644–54. Дои:10.1152/japplphysiol.00669.2007. PMID 17872405.
- ^ а б c d Хаддад, Ф; Adams, GR; Bodell, PW; Baldwin, KM (February 2006). "Isometric resistance exercise fails to counteract skeletal muscle atrophy processes during the initial stages of unloading". Журнал прикладной физиологии. 100 (2): 433–41. Дои:10.1152/japplphysiol.01203.2005. PMID 16239603.
- ^ Фелиц, Йенс; Kim, Mi-Sung; Shelton, John M.; Latif, Shuaib; Spencer, Jeffrey A.; Glass, David J.; Richardson, James A.; Bassel-Duby, Rhonda; Olson, Eric N. (September 2007). "Myosin accumulation and striated muscle myopathy result from the loss of muscle RING finger 1 and 3". Журнал клинических исследований. 117 (9): 2486–2495. Дои:10.1172/JCI32827. ЧВК 1957544. PMID 17786241.
- ^ Fitts, RH; Bodine, SC; Romatowski, JG; Widrick, JJ (May 1998). "Velocity, force, power, and Ca2+ sensitivity of fast and slow monkey skeletal muscle fibers". Журнал прикладной физиологии. 84 (5): 1776–87. Дои:10.1152/jappl.1998.84.5.1776. PMID 9572830.
- ^ а б Fitts, RH; Desplanches, D; Romatowski, JG; Widrick, JJ (November 2000). "Spaceflight effects on single skeletal muscle fiber function in the rhesus monkey". Американский журнал физиологии. Регуляторная, интегративная и сравнительная физиология. 279 (5): R1546–57. Дои:10.1152/ajpregu.2000.279.5.r1546. PMID 11049835.
- ^ а б Kischel, P; Стивенс, L; Montel, V; Picquet, F; Mounier, Y (May 2001). "Plasticity of monkey triceps muscle fibers in microgravity conditions". Журнал прикладной физиологии. 90 (5): 1825–32. Дои:10.1152/jappl.2001.90.5.1825. PMID 11299273.
- ^ Recktenwald, MR; Hodgson, JA; Roy, RR; Riazanski, S; McCall, GE; Kozlovskaya, I; Washburn, DA; Fanton, JW; Edgerton, VR (May 1999). "Effects of spaceflight on rhesus quadrupedal locomotion after return to 1G". Журнал нейрофизиологии. 81 (5): 2451–63. Дои:10.1152 / jn.1999.81.5.2451. PMID 10322080.
- ^ Рой, Р.Р .; Hodgson, JA; Арагон, Дж; День, МК; Козловская, I; Edgerton, VR (апрель 1996 г.). «Рекрутмент камбаловидного резуса и медиальной икроножной мышцы до, во время и после космического полета». Журнал гравитационной физиологии: журнал Международного общества гравитационной физиологии. 3 (1): 11–5. PMID 11539303.
- ^ а б Белый, Рональд Дж .; Макфи, Дженси К. (2007). «Цифровой астронавт: интегрированная система моделирования и базы данных для космических биомедицинских исследований и операций». Acta Astronautica. 60 (4–7): 273–280. Bibcode:2007AcAau..60..273Вт. Дои:10.1016 / j.actaastro.2006.08.009.
- ^ Scheuring, Ричард А .; Джонс, Джеффри А .; Новак, Джозеф Д .; Полк, Джеймс Д.; Гиллис, Дэвид Б.; Шмид, Йозеф; Дункан, Джеймс М .; Дэвис, Джеффри Р. (1 октября 2008 г.). «Медицинский проект Аполлона: Рекомендации по улучшению здоровья и производительности экипажа для будущих исследовательских миссий и операций на поверхности Луны». Acta Astronautica. 63 (7–10): 980–987. Bibcode:2008AcAau..63..980S. Дои:10.1016 / j.actaastro.2007.12.065. HDL:2060/20070030109.
внешняя ссылка
- Ламбертц, Даниэль; Перо, Шанталь; Каспранский, Рустем; Губель, Фрэнсис (1 января 2001 г.). «Влияние длительного космического полета на механические свойства мышц человека». Журнал прикладной физиологии. 90 (1): 179–188. Дои:10.1152 / jappl.2001.90.1.179. ISSN 8750-7587. PMID 11133909.
- Vandenburgh, H; Chromiak, J; Шанский, Дж; Дель Татто, М; Лемэр, Дж (июнь 1999 г.). «Космические путешествия напрямую вызывают атрофию скелетных мышц». FASEB J. 13 (9): 1031–8. Дои:10.1096 / fasebj.13.9.1031. PMID 10336885. S2CID 24300144.
- Джекман, RW; Кандарян, Южная Каролина (октябрь 2004 г.). «Молекулярные основы атрофии скелетных мышц». Am J Physiol Cell Physiol. 287 (4): C834–43. Дои:10.1152 / ajpcell.00579.2003. PMID 15355854.
![]() Эта статья включаетматериалы общественного достояния от Национальное управление по аэронавтике и исследованию космического пространства документ: «Здоровье человека и риски при выполнении космических миссий» (PDF). (НАСА SP-2009-3405)
Эта статья включаетматериалы общественного достояния от Национальное управление по аэронавтике и исследованию космического пространства документ: «Здоровье человека и риски при выполнении космических миссий» (PDF). (НАСА SP-2009-3405)

